
【题目】金属是人类利用最广泛的材料之一,请用所学的化学知识回答下列问题。
(1)生铁和钢都是铁的合金,其区别是_____。
(2)铝在常温下易与空气中的氧气反应生成一层致密的保护膜,因而铝具有良好的抗腐蚀性能,该保护膜的成分是_____。
(3)如图为某学习小组探究金属化学性质时所做的四个实验,仔细分析后回答下列问题:
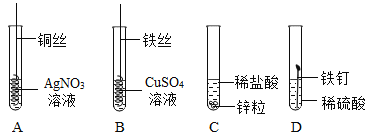
①描述A中的实验现象_____。
②写出C中反应的化学方程式_____。
③要证明Cu、Fe、Ag的活动性顺序,至少要做的实验是_____(填序号)。
④开始反应后D中溶液逐渐变为黄色,原因是_____(化学方程式)。
(4)某课外小组采集到一批铁矿石标本,经检测后发现该矿石中Fe2O3的质量分数为80%,若用300t该矿石,理论上可冶炼出铁含量为96%的生铁的质量是_____。
(5)在Fe(NO3)2和AgNO3的混合溶液中,加入一定量的锌粉,充分反应后过滤,,得到滤渣和滤液。下列说法中正确的是_____(填序号)。
a、若滤液为浅绿色,则滤渣中可能有锌
b、滤液中一定有Zn(NO3)2,滤渣中一定有银
c、若取少量滤液,加入KC1溶液,无明显现象,则滤渣中一定有铁
d、若取少量滤渣,加入稀盐酸,产生气泡,则滤渣的组成有三种情况
(6)将10g氧化铜和铜的混合物放入烧杯中,加入100g溶质质量分数为7.3%的稀盐酸,恰好完全反应,则原10g氧化铜和铜的混合物中铜元素的质量分数为_____。
【答案】含碳量不同 A12O3 铜丝表面有银白色固体析出,溶液由无色变蓝色 ![]() AB
AB ![]() 175t b 84%
175t b 84%
【解析】
(1)生铁的含碳量在2%~4.3%之间,钢的含碳量在0.03%~2%之间,即生铁与钢的区别是含碳量不同,故填含碳量不同。
(2)铝的化学性质比较活泼,在常温下就能与空气中的氧气反应生成致密的氧化铝,对内层的铝起保护作用,氧化铝的化学式为A12O3,故填A12O3。
(3)①A中的反应是铜与硝酸银反应生成银和硝酸铜,观察到的现象是铜丝表面有银白色固体析出,溶液由无色变蓝色,故填铜丝表面有银白色固体析出,溶液由无色变蓝色;
②C中的反应是锌与稀盐酸反应生成氯化锌和氢气,故反应的化学方程式写为:Zn+2HCl=ZnCl2+H2↑;
③A实验中铜能够与硝酸银反应生成银和硝酸铜,证明铜的活动性比银强,B实验中铁能够与硫酸铜反应生成硫酸亚铁和铜,证明铁的活动性比铜强,要证明Cu、Fe、Ag的活动性顺序,至少要做的实验是AB,故填AB;
④开始反应后D中溶液逐渐变为黄色是因为铁钉表面的铁锈中的氧化铁与硫酸反应生成硫酸铁和水,硫酸铁溶于水后溶液呈黄色,故反应的化学方程式写为:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O。
(4)设可冶炼出铁含量为96%的生铁的质量为x
300t×80%×![]() ×100%=x×96%
×100%=x×96%
x=175t,故填175t。
(5)a 若滤液为浅绿色,滤液中一定含有硝酸亚铁,则反应中锌的量不足,没有将硝酸亚铁完全置换,则滤渣中一定没有锌,选项错误;
b 加入的锌粉先与活动性较弱的银的盐溶液硝酸银反应生成银和硝酸锌,所以滤液中一定有Zn(NO3)2,滤渣中一定有银,选项正确;
c 若取少量滤液,加入KC1溶液,无明显现象,证明硝酸银完全与锌反应生成了银和硝酸锌,则滤渣中一定有银,不能判断是否含有铁,选项错误;
d 题目中出现的金属中只有锌、铁能够与稀盐酸反应产生气泡,若取少量滤渣,加入稀盐酸,产生气泡,则滤渣可能的组成有银、铁或银、铁、锌两种情况,选项错误,故填b。
(6)参加反应的纯净HCl的质量=100g×7.3%=7.3g
设样品中氧化铜的质量为x

80:73=x:7.3g x=8g
氧化铜中铜元素的质量=8g×![]() ×100%=6.4g
×100%=6.4g
原10g氧化铜和铜的混合物中铜元素的质量分数=![]() ×100%=84%
×100%=84%
答:原10g氧化铜和铜的混合物中铜元素的质量分数为84%。


科目:初中化学 来源: 题型:
【题目】配制100g质量分数为16%的Na2CO3溶液,用于演示灭火器原理。回答下列问题
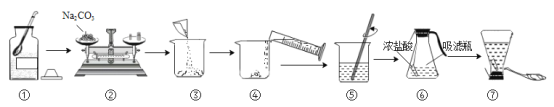
(1)计算Na2CO3的质量为____g,称量Na2CO3的仪器名称是____
(2)20℃时,Na2CO3的溶解度为21.5g,⑤中的溶液______(填“是”或“不是”)该物质的饱和溶液
(3)将烧杯中溶液倒入吸滤瓶的操作是________。从橡胶管喷出大量液体的原因是___
(4)酒精(C2H5OH)可作燃料,在空气中完全燃烧的化学方程式是_______。酒精燃烧失火,可用干粉灭火器灭火。NaHCO3是干粉的主要成分,俗称是________。用干粉灭火器灭火的正确操作顺序是______→_____→______(填序号)

查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据下列实验装置图,请回答问题。
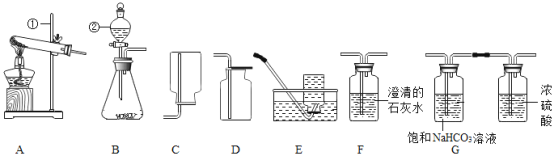
(1)写出标有① ②序号的仪器名称:①______,②_______。
(2)实验室用石灰石和稀盐酸制取二氧化碳时,发生装置是_____,检验二氧化碳应选用的装置是___,该装置内发生反应的化学方程式为_____________。
(3)若要收集一瓶干燥纯净的二氧化碳,所选装置正确的连接顺序是气体发生装置→__→___(选填装置字母序号)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】将一定质量的NaOH溶液与Na2CO3溶液中加入稀盐酸,产生气体与加入稀盐酸的体积的关系如图所示,下列说法中正确的是( )
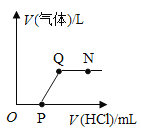
A.N 点时,所得溶液的pH=7
B.N点时,所得溶液中的溶质只含有NaCl
C.O至P段发生反应的化学方程式为NaOH+HCl=NaCl+H2O
D.Q至N段发生反应的化学方程式为Na2CO3+2HCl=2NaCl+H2O+CO2
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列表中各物质不能按照图中关系(“→”表示反应一步完成)转化的是
物质选项 | A | B | C | D |
X | Na2SO4 | BaCl2 | Cu | CaO |
Y | NaCl | Ba(NO3)2 | CuO | CaCl2 |
Z | NaNO3 | BaCO3 | CuSO4 | CaCO3 |
A.AB.BC.CD.D
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是甲、乙、丙三种固体物质的溶解度曲线。
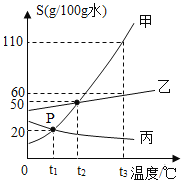
①P点的含义__________。
②要使接近饱和的甲溶液变成饱和溶液,可采用的方法有_________(写出一种)。当甲溶液中含有少量乙时,可采用__________的方法提纯甲。
③t2℃时,将30 g甲物质放入50 g水的烧杯中,所得溶液溶质的质量分数为_______(精确到0.1)。若烧杯内物质升温到t3℃(不考虑水蒸发),溶液中变化的是___________。
Ⅰ溶质的质量
Ⅱ溶剂的质量
Ⅲ溶质的质量分数
④t1℃时甲、乙、丙三种物质的饱和溶液同时升温到t2℃,此时溶液中溶质质量分数的大小关系是_________。
⑤t2℃时,在含有50 g水的甲和乙的饱和溶液中,分别加入m g甲和m g乙,升温至t3℃,甲完全溶解,乙仍有剩余,则m的质量范围是_________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】钴(Co)的化合物在锂电池中有很好的应用,LiCoO2(钴酸锂)在酸性介质中有强氧化性,其化学方程式为:2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+4H2O+O2↑,已知锂与钠有相似的化学性质,且反应中只有钴和氧元素的化合价发生了改变,则下列说法正确的是( )
A.该反应是复分解反应
B.该反应中钴的化合价由+3价变为+2价
C.该反应中氧的化合价降低
D.钴酸根离子式![]()
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】结合下图有关实验,回答问题。

(1)铁丝在氧气中燃烧时集气瓶内预先加入少量水的原因是_____。
(2)过滤操作中玻璃棒的作用是__________;
(3)对比一段时间后三枚铁钉生锈程度,可以得出铁生锈的条件是___________。
(4)烧杯中白磷(着火点40℃)不燃烧的原因是_________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】硒元素有防癌和抗癌作用,如图,甲是硒的原子结构示意图,乙是硒元素在元素周期表中的信息,下列说法正确的是
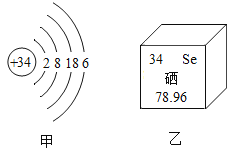
A.硒原子核内中子数为34
B.硒原子在化学反应中易得到电子
C.硒元素的元素符号为Se,是一种金属元素
D.硒的相对原子质量为78.96g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com