
【题目】如图是A、B两种固体物质的溶解度曲线。
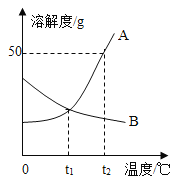
(1)当温度为________℃时,A、B两种物质的溶解度相等。
(2)欲使饱和状态的B溶液变成不饱和溶液,可采用的一种方法是________。
(3)t2℃时,将30gA物质加入50g水中,充分溶解后,所得溶液中溶质与溶液的质量比是________。
科目:初中化学 来源: 题型:
【题目】如图是初中化学中常见物质间的转化关系,其中甲、乙、丙为单质;A、B、C、D、E为化合物,且A与B的组成元素相同,D与E的组成元素也相同。已知C、丙均为黑色粉末,C和E在高温条件下可生成丙和D,其余反应条件、部分反应物和生成物均已略去。试推断:
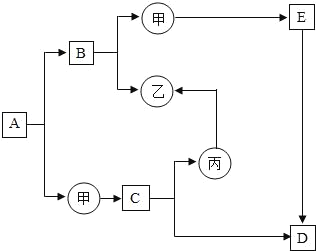
(1)写出有关物质的化学式:A_____、甲_____、E_____;丙_____
(2)写出下列化学方程式:
A→B+甲:_____;
C+E→丙+D:_____。
丙→乙:_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组的同学学习“灭火器原理”后,设计了如下图所示实验,并对反应后瓶中残留废液进行探究。
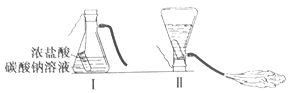
(提出问题)废液中所含溶质是什么?
(猜想与假设)
猜想1:废液中的溶质是NaCl、Na2CO3和HCl
猜想2:废液中的溶质只有NaCl
猜想3:废液中的溶质是NaCl、HCl
猜想4:废液中的溶质是______。
(讨论与交流)
小明认为猜想I无需验证就知道是错误的,他的理由是_____(请用化学方程式说明)。
(实验与结论)
(1)小亮同学为验证猜想3,取少量废液装入试管中,然后滴入酚酞溶液,发现溶液不变色,于是小亮认为猜想3正确。你认为他的结论____(填“正确”或“错误”),理由是______________。
请你另设计实验方案验证猜想3:
实验步骤 | 实验现象 | 实验结论 |
__________________ | __________________ | 猜想3正确 |
(2)验证猜想4,可选择的试剂有____________。
A.酚酞溶液B.氢氧化钾溶液C.稀硫酸D.氯化钡溶液
(拓展与应用)若废液中的溶质是NaCl和HCl,根据盐酸的性质,无需另加试剂,只要对废液进行____操作,即可从废液中得到NaCl固体。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】老师要求用规定量的BaCl2溶液与适量的Na2SO4溶液制备BaSO4。完成操作Ⅰ后。丁丁发现自己错把Na2CO3溶液当成Na2SO4溶液,而此时BaCl2溶液已完全消耗。老师启发他,可用生成物和其他试剂完成制备BaSO4的实验。整个实验流程如下图所示:
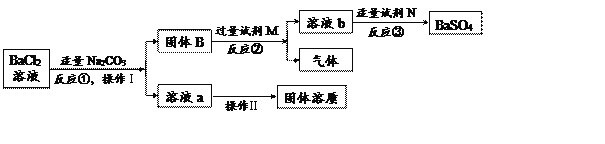
(1)反应②的化学方程式为_________________________________,溶液b中的溶质有____________。
(2)反应③的基本反应类型为___________________。
(3)操作Ⅱ的名称为___________________。
(4)从理论上讲,该实验过程最终得到的BaSO4质量与原方案得到的BaSO4质量是否相等?________(填“是”或“否”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】碳元素是组成许多物质的基本元素,回答下列有关问题,
(1)倡导”低碳”生活,主要为了减少_____的排放量,
(2)检验二氧化碳,常用澄清石灰水,写出该反应的化学方程式:_____,
(3)写出天然气(主要成分是CH4)燃烧的化学方程式:_____。
(4)金刚石和石墨物理性质差异很大的原因是,_____。
(5)CO和CO2的化学性质差异很大的原因是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】向装有过量锌粉的烧杯中加入一定质量AgNO3和Cu(NO3)2的混合溶液,烧杯中固体的质量随反应时间变化的情况如图所示。下列说法正确的是( )
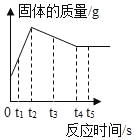
A. t<t2时,若向溶液中滴加NaCl溶液,无明显变化
B. t1时,溶液中金属离子有3种,固体中金属单质有2种
C. t3和t5时,溶液中的溶质种类不同,金属单质种类也不同
D. t1<t<t2时,若向溶液中插入铝丝,铝丝表面有红色固体析出
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】用铝土矿(主要含SiO2、Al2O3和少量Fe2O3等)制取铝硅合金材料有干法、湿法等方法,其中干法制备的工艺流程如图所示。
(已知:I.SiO2不溶于水、不与硫酸反应。Ⅱ.转化率是反应物转化为生成物的百分率。)
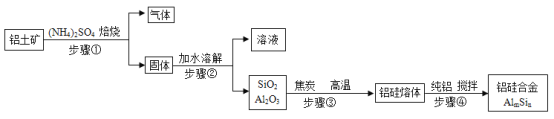
(1)铝硅合金的硬度比纯铝的硬度_______。
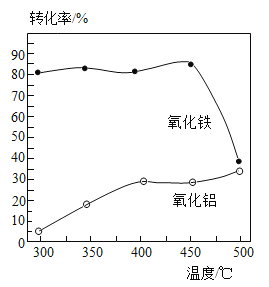
(2)步骤①中焙烧除铁的反应为:4(NH4)2SO4+Fe2O3![]() 2NH4Fe(SO4)2+3H2O+6NH3↑(Al2O3部分发生类似反应,SiO2不发生类似反应)。已知Fe2O3、Al2O3转化为硫酸盐的转化率与温度的关系如图所示,则焙烧除铁最适宜的温度为_______℃。
2NH4Fe(SO4)2+3H2O+6NH3↑(Al2O3部分发生类似反应,SiO2不发生类似反应)。已知Fe2O3、Al2O3转化为硫酸盐的转化率与温度的关系如图所示,则焙烧除铁最适宜的温度为_______℃。
(3)步骤②中包括加水溶解、_______、洗涤等操作。
(4)步骤③中利用焦炭还原SiO2、Al2O3会产生中间体SiC、Al4C3.写出高温下Al4C3与Al2O3反应生成A1和CO的化学方程式:_______。
(5)若用湿法处理铝土矿,加过量的硫酸浸取,所得溶液中的阳离子有_______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】以软锰矿粉(主要含MnO2,还有少量Fe2O3)为原料制取MnCO3的流程如图1.
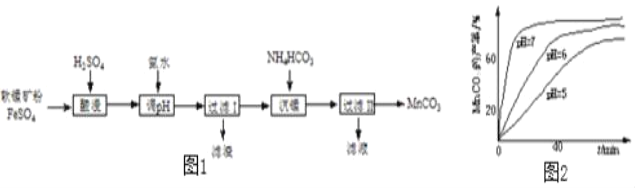
(1)“酸浸”时发生的反应有2FeSO4+MnO2+2H2SO4=_____+MnSO4+2H2O和_____。
(2)“过滤Ⅰ”所得滤渣的主要成分是_____。
(3)“沉锰”时测得MnCO3的产率与溶液pH、反应时间t的关系如图2,反应要控制pH=_____,其理由是_____、_____。
(4)“过滤Ⅱ”所得滤液中溶质的主要成分是_____。
(5)为测定某软锰矿中MnO2的质量分数,称取2.0 g软锰矿样品,加入3.35 g草酸钠(Na2C2O4)固体,再加足量稀硫酸(杂质不参加反应),充分反应后,过量的Na2C2O4用31.6 g/L KMnO4溶液进行反应,当滴入10.0 mL KMnO4溶液时恰好完全反应。
已知:①MnO2+Na2C2O4+2H2SO4=MnSO4 +2CO2↑+2H2O+Na2SO4 ;②2KMnO4+5Na2C2O4+8H2SO4=2MnSO4+5Na2SO4+K2SO4+10CO2↑+8H2O.
求该软锰矿中MnO2的质量分数。_____(相对分子质量:KMnO4 158;Na2C2O4 134;MnO2 87)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com