
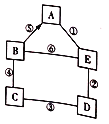
����Ŀ��A��B��C��D��E�ֱ�������ͭ���������ơ�þ������þ�������е�һ�����ʡ�C����ˮ��Һ����ɫ������֮��ķ�Ӧ��ת����ϵ��ͼ��ʾ(����������ʾ�������ܷ�����ѧ��Ӧ����������ʾһ�����ʾ�һ����Ӧ��ת��Ϊ��һ������)���ش�����������
(1)���ŵ��������ƹ����׳���ͱ��ʣ������������Ҫ_____________���档
(2)д������E��һ����;______________��
(3)������Ӧ��ת����ϵ��ͼ�й���_____���Ǹ��ֽⷴӦ��
(4)д��C��D��Ӧ�Ļ�ѧ����ʽ__________________��
(5)�ܱȽ����ֽ������ǿ���ķ�Ӧ��(���������)__________��
���𰸡� �ܷ� ��ȥ������������� 3 CuSO4+2NaOH==Cu(OH)2��+Na2SO4 ��
��������C��������ˮ����ɫ����C����������ͭ��C������BD��Ӧ����BD���������ƺͽ���þ����AE������þ��ϡ���ᣬ����B������A����B��þ��A������þ��D���������ƣ�E��ϡ���ᣬ���ƶϣ��ý�����ȷ��
��1�����������׳���ͱ��ʣ����������Ʊ���ʱҪ�ܷⱣ����
��2��E������ϡ���ᣬ���������������ﷴӦ���ʿ����ڳ�ȥ������������⣻
��3���������뻯���ﻥ�ཻ���ɷ������µĻ��������µĻ�����ķ�Ӧ�и��ֽⷴӦ��ͼ���Ǹ��ֽⷴӦ��������ͭ���������Ƶķ�Ӧ���������ƺ�ϡ����ķ�Ӧ��ϡ���������þ�ķ�Ӧ���ʹ���3�����ֽⷴӦ��
��4������ͭ���������Ʒ�Ӧ����������ͭ�����������ƣ���Ӧ����ʽΪCuSO4+2NaOH==Cu(OH)2��+Na2SO4 ��
��5����Ӧ���ǽ���þ������ͭ�ķ�Ӧ����ͭ������þ��þ�ܰ�ͭ������ͭ���û�������˵��þ��ͭ���ã��٢ڢݢ���û���漰���ֽ����ķ�Ӧ���ʲ��ܱȽ����ֽ����Ļ��ǿ������Ӧ���Ǹ��ֽⷴӦ������˵��ͭ���ƵĻ��ǿ������ѡ����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������鸻�������ʡ�̼ˮ�����������֬���ᡢ������(�ơ��ס���)�����岻�ܺϳɵ�8�ֱ��谱���ᡢ���ܲ��ؼ�����ά���صȣ����н�Ƣ�������ʪ�ȹ�Ч������Ӫ����ֵ���߶�����������������֮�ơ�
��������Ĺ��������ǣ������п�������ëù����������(����ˮ�֣�ʹ��������Ӳ��ͬʱ����������������������������ܱ���)����±��װƿ(�γɶ��ط�ζ)���ܷ����Ʒ��������鷢�ͷ�Ϊǰ�����͡�ǰ��������ۻ�øϵ�Ĺ��̣�һ��Ϊ36~48 h�������øϵ�����ڸ�������Ĺ��̣���ʱ�ϳ���һ��Ϊ3��6���¡�
����֡����ϡ�����ʱ��ͺ���ʱ��ȵIJ�ͬ�����鰴ɫ���ζ��Ϊ�츯�顢���顢�ฯ��(����������)��������ȡ��츯��ĺ�ɫ��Ҫ�Ǻ����������ĺ�ɫɫ�أ���������ɫ�ǻ�ͪ�����ʣ���ø�����»��������������ฯ��ĵ���ɫ�ǰ�����ֽ����ɵ�����������ӽ�ϲ����ġ�
���鷢������ʳ�κ����Ի�ѧ��ֵ�Ӱ������ͼ��ʾ��

������ʳ�κ����ʺ����ձ�ϸߣ���Ѫѹ����Ѫ�ܲ���ʹ�硢�������������������ߣ����ٳԻԣ�������ز��顣�����鷢�ͺ����ױ�������Ⱦ����������鶹�����еĵ����ʻ�������������Ļ���������̫��ij����飬Ӱ�����彡����
������������ˮƽ����ߺ��õķ�չ�����ǶԸ��������Ҫ��Խ��Խ�ߡ�
�����������ݣ��ش��������⡣
(1)�����鱻��Ϊ������������������Ϊ__________��
(2)������������Ĺ��������У����������仯����__________��
A�������п� B������ëù C������װƿ D.�ܷⷢ��
(3)�������еĺ���������__________ת�����ɵġ�
(4)�������������У���Ӧ��������ʳ�Σ���������__________��
(5)���й��ڸ����˵���У���������__________��
A�����麬�зḻ�ĵ����� B���ڸ��鷢�����У�pH��С
C����Ѫѹ����Ѫ�ܲ���Ӧ�ٳԻԸ��� D���������ɫ����ͨ��������Ӧ�γɵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ����������кܶ���ˮ�������������Dz��ľ��صIJ�����γء�ij�κ�������ũ��ͨ���������̼����ɹ�Ρ���ô������Ρ�Сΰͬѧȡ�ú�����Ʒ����̽����
��������⣩�ú�����Ʒ�ijɷ���ʲô��
���������ϣ������̼�ġ��ָNa2CO3������ɹ�εġ��Ρ�ָNaCl��
����������裩����һ��Na2CO3
�������NaCl
��������Na2CO3��NaCl
��ʵ��̽����
ʵ�� | ʵ����� | ʵ������ | ʵ����� |
ʵ��һ | ȡ������Ʒ���Թ��У�������ˮ�ܽ�������ϡHNO3 | ������ʹ����ʯ��ˮ����ǵ����� | �ٲ���_____������ |
ʵ��� | ����ʵ��һ���õ���Һ�м���������_____ | ��_____ | ���������� |
����չ���죩Ϊ��һ��ȷ���ú�����Ʒ��Na2CO3������������Сΰͬѧ��ȡ�ú�����Ʒ10.00g������ͼ��ʾ�IJ���ʵ�顣
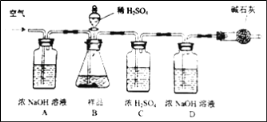
��1����Ӧ����֮��ͨ�������Ŀ����_____��
��2��װ��A��ŨNaOH��Һ��������_____���÷���ʽ��ʾ����
��3��ʵ���������װ��D����0.44g���������Ʒ��Na2CO3����������Ϊ_____%������һλС������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ���ش��������⡣
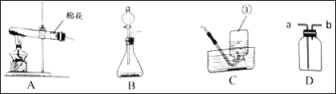
��1��ͼ�б�����Ţٵ�����������_____��
��2��ʵ�����и��������ȡ������Ӧ�Ļ�ѧ����ʽ��_____��Ӧѡ��ķ���װ����_____ ������ţ���
��3������Dװ���ռ�������������Ӧ��_____���a����b�����˽��롣
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�Ǽס��ҡ������ֹ������ʵ��ܽ�����ߡ�����˵����ȷ����
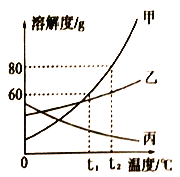
A. �������ʵ��ܽ�ȶ����¶ȵ����߶�����
B. t2��ʱ�������ʵ��ܽ����60g
C. ��t2��ļס��ҡ����������ʵı�����Һ���µ�t1�棬���õ���Һ��Ȼ�DZ�����Һ���Ǽ���
D. t1��ʱ��50g����50gˮ�г�ֽ���ɵ���Һ100g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ҿ��Ժϳ����ȼ�ϱ����۹�����ͼ��ʾ������˵������ȷ���ǣ�������![]()
A. ��������̼Ԫ�ص������������
B. �����������л���������ܼ���������
C. �÷�Ӧ�й�������������
D. �÷�Ӧ�вμӷ�Ӧ�ļ����������ʵķ��Ӹ�����Ϊ1��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݴ�����ʵ���ܽ�ó������֮����������ֽⷴӦ�������ǣ����������г����������ˮ�����ݸ�������ij��ѧС���ͬѧ�ƶ�ϡ������Ȼ�þ��Һ���ܷ������ֽⷴӦ��Ϊ�˽�һ��ȷ�ϸ��ƶϵĿɿ��ԣ���С��ͬѧ��һ����ϡ�����һ�����Ȼ�þ��Һ���ձ��л�Ϻ���������̽�����
��1����ͬѧȡ�ձ��л����Һ�ֱ������������ʵ�飬��¼ʵ���������¡�������ʵ��������дʵ����ۣ�
ʵ�� | ʵ������ | ʵ����� |
| ��Һ��� | ��Һ�к���_____��д���ӷ��ţ� |
| ������ɫ���� | ��Һ�к���_____��д���ӷ��ţ� |
����ͬѧ�Ľ��ۣ�ϡ�������Ȼ�þ��Һû�з�����Ӧ | ||
��2����ͬѧ������ͬѧ��ʵ�鱨�����Ϊ��ͬѧ�Ľ��۲���ȷ��ԭ����_____��Ϊ�˽�һ��ȷ������û������Ӧ����������ձ��ڵĻ��Һ���Ƿ����Ȼ�þ�����ǣ���ͬѧ�������������ʵ�飺
��ȡ�����ձ��ڵĻ��Һ���Թ��У���μ��������_____��Һ��֤���˻��Һ�к���Mg2+������ʵ���������ͬѧ�۲쵽��ʵ��������_____��
����ͬѧ��ȡ�����ձ��ڵĻ��Һ��ͨ��ʵ��ɹ��ؼ�������Һ�к���Cl��������Ƶķ���Ϊ_____��д������������
���ܽᣩͨ������ʵ�飬��С��ͬѧ֤����ϡ������Ȼ�þ��Һȷʵû�з�����Ӧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��ͬ�����£����������ȼ�����Ӹ�������һ�������£��±���ʾ���������ܱյ������ڳ�ַ�Ӧ����÷�Ӧǰ������ʵ��������±���
���� | X | ���� | ˮ | ������̼ | һ����̼ |
��Ӧǰ����/g | 3.2 | 11.2 | 0 | 0 | 0 |
��Ӧ������/g | 0 | 0 | 7.2 | 4.4 | a |
(1)��ͬ�����¸÷�Ӧ���ɵ�CO��CO2��������Ϊ________�������Ϊ________��
(2)��ҪʹX���ȼ�գ��������ӵ�����������Ϊ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ⶨ�������Ȼ��ƵĻ����Һ���Ȼ��Ƶ���������������������ʵ�飺ȡ�����Һ100g����ƿ�У�����������һ����������������̼������Һ(��ͼһ)�������ϲⶨ��ƿ����Һ��pH����Ӧ������������Һ��pH����ƿ�����ʵ��������Ĺ�ϵ��ͼ����ʾ�����У�����ƿ����Һ������������147.8gʱ��������̼������Һ������Ϊ50g��(���Զ�����̼��ˮ���ܽ�������Ȼ�����Һ�����ԡ�)
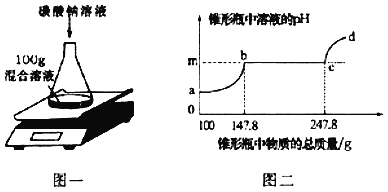
(1)m�����ֵ��_____��
(2)a��b�α�ʾ̼����������Һ�е�_____��Ӧ��
(3)�μӷ�Ӧ��̼������Һ�����ʵ�����������_____��
(4)�����ԭ�����Һ��CaCl2����������Ϊ_______(д�������)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com