
【题目】下列实验设计能达到实验目的是
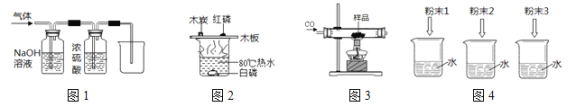
A. 用图1装置除去CO中的CO2,回收COB. 用图2装置探究可燃物燃烧所需的条件
C. 用图3装置除去氧化铜样品中的铜粉D. 用图4鉴别NH4NO3、CuSO4和NaCl 三种白色粉末
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:初中化学 来源: 题型:
【题目】(10分)组成相似的盐具有一些相似的化学性质。
(1)①Cu(NO3)2溶液和CuSO4溶液都含有大量 (填离子符号)。
②向Cu(NO3)2溶液中加入NaOH溶液,充分振荡。反应的化学方程式为 。
③向CuSO4溶液中加入过量的锌片,充分反应后,可看到的现象是 ,下图表示该反应前后溶液中存在的主要离子,请写出每种图形代表的离子(填离子符号)

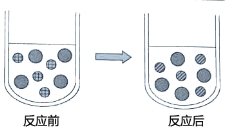
(2)除上述实验外,在溶液中与Cu(NO3)2和CuSO4均能反应的物质还有 、
(任举二例,填化学式,下同)
(3)在溶液中能与CuSO4反应而不与Cu(NO3)2反应的物质有 (任举一例)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】现有一包固体粉末,可能由CaCO3、CaO、Fe2O3 、KNO3、Na2CO3中的一种或几种组成。
为确定其组成,进行了如下图所示的实验(假设实验过程无损耗)。请回答:
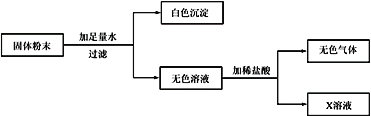
(1)白色沉淀是____;原固体粉末中一定含有___,该白色固体的可能组成有___种。
(2)氧化钙和水反应的化学方程式是____。
(3)若实验取固体粉末20.0g,生成白色沉淀10.0g,最后得到溶质质量分数为5.85%的X溶液200.0g(只含一种溶质),则原固体粉末由___组成。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(4分)我市东部山区盛产石灰石,某校课外活动小组为了解石灰石资源的品质,采用两种方案对当地石材进行化学分析:
方案一: 取10g石灰石粉末样品置于下图所示装置,充分加热至质量恒定,冷却后称得固体质量为8.12g
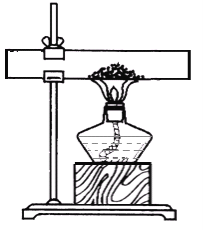
方案二:另取10g同质地石灰石颗粒样品,置于烧杯中加足量稀盐酸,充分反应后称得混合物的总质量减少了4.27g
相关资料:
当地石灰石含有的主要杂技为二氧化硅,其化学性质稳定,加热不易分解且不与盐酸发生化学反应.
计算出两种方案测得的石灰石中碳酸钙的质量分数:
(1)方案一中碳酸钙的质量分数是 ;
(2)方案二中碳酸钙的质量分数是 .(精确到0.1%)
比较两方案测量的结果,分析两方案误差较大的可能原因?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据表中内容回答下列问题。
温度 溶解度 物质 | 0 | 20 | 40 | 60 | 80 |
|
|
|
| 110 | 169 |
NaCl |
|
|
|
|
|
|
|
|
|
|
|
![]() 随温度升高,
随温度升高,![]() 溶解度的变化趋势是______
溶解度的变化趋势是______![]() 填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变”![]() 。
。
![]() 根据上表推断硝酸钾与氯化钠溶解度相等时的温度范围是______。
根据上表推断硝酸钾与氯化钠溶解度相等时的温度范围是______。
![]() 取
取![]() 、NaCl两种固体各36g分别放入
、NaCl两种固体各36g分别放入![]() 时的100g水中充分溶解,
时的100g水中充分溶解,![]() 时存在如图1所示的实验现象,烧杯b中溶解的物质是______;烧杯a所得溶液溶质的质量分数是______
时存在如图1所示的实验现象,烧杯b中溶解的物质是______;烧杯a所得溶液溶质的质量分数是______![]() 结果精确到
结果精确到![]() ,若要使其溶质质量分数增大可采用的方法是______。
,若要使其溶质质量分数增大可采用的方法是______。
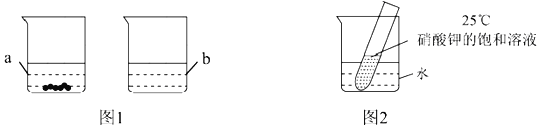
![]() 如图2所示,若向烧杯中加入足量的硝酸铵固体并使之充分溶解,在试管中可观察到的现象是______。
如图2所示,若向烧杯中加入足量的硝酸铵固体并使之充分溶解,在试管中可观察到的现象是______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】煤燃烧后的煤灰粉末(主要含氧化铝、二氧化硅等物质)可制备碱式硫酸铝[Al2(OH)6-2X(SO4)X]溶液,并进行烟气脱硫的探究,其实验流程如下图所示:
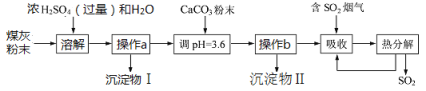
资料:二氧化硅难溶于水和酸,也不与其发生反应。H2SO3受热易分解,其酸性弱于H2SO4;H2SO4受热不易分解。
(I)Al2(OH)6-2X(SO4)X中铝元素的化合价为________。
(2)“溶解”时,先将煤灰粉末倒入烧杯中,接下来的具体操作是:___________,主要的反应方程式为_____________。
(3)操作a、b的名称为________,沉淀物Ⅰ的主要成分为_______________(填化学式)。
(4)不断加入CaCO3粉末使溶液的pH升高到3.6,其作用是____________________并使Al2(SO4)3转化为Al2(OH)6-2X(SO4)X。
(5)流程中,“热分解"时溶液中的部分H2SO3会被氧化为H2SO4,则完全“热分解”放出的SO2量总是__(填“大于”、“小于"或“等于”吸收的SO2量,“热分解"后循环利用的溶液pH_______(填“大于”、“小于"或“等于")吸收SO2之前的溶液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】铬是最硬的金属,常镀在金属制品如水龙头的表面,使金属制品美观耐用.将打磨的相同大小的铬片、铝片和铜片分别置于等质量等质量分数的稀硫酸中,观察到铬片表面缓慢产生气泡,铝片表面迅速产生较多气泡,铜片表面无现象.请写铬、铝、铜金属活动性由强到弱的顺序是(1)_____.
如图为某学习小组探究金属化学性质时所做的四个实验,仔细分析后回答下列问题:
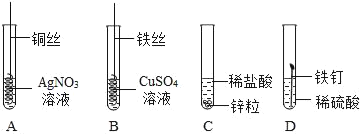
(2)描述A中的实验现象_____,并写出方程式_____
(3)写出C中反应的化学方程式_____.
(4)要证明Cu、Fe、Ag的活动性顺序,至少要做的实验是_____ (填序号).
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图所示,进行中和反应实验
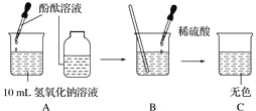
(1)B中发生中和反应的化学方程式_____。
(2)写出C的溶液(除酚酞外)溶质可能存在的几组情况_____(用化学式表示)
(3)反应过程中,不断滴入稀硫酸的话,温度会如何变化?_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】两个烧杯中分别盛装X、Y的饱和溶液,两只试管中分别装有NaOH和NH4NO3固体,向两只试管中分别滴加适量水,现象如图一所示,结合图二判断下列说法正确的是( )
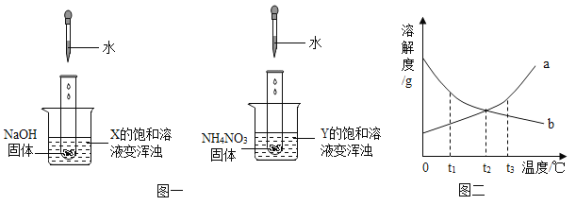
A.Y的溶解度曲线为b曲线 B.降温可使X的饱和溶液变浑浊
C.X的饱和溶液从t2℃降温到t1℃,溶质的质量分数变大
D.t3℃时,X、Y的饱和溶液质量相等,则溶剂质量X>Y
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com