
【题目】下图是甲、乙、丙三种固体物质的溶解度曲线。根据图示回答下列问题:
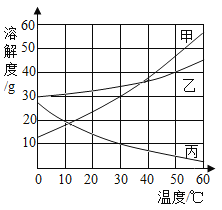
(1)30℃时,甲、乙、丙三种物质的溶解度由大到小的顺序是____;
(2)当甲中混有少量的乙时,可采用____方法提纯甲;
(3)30℃时,将10g甲物质加入到盛有50g水的烧杯中,充分溶解后,所得溶液是____(填“饱和”或“不饱和”)溶液;
(4)50℃时,分别配制甲、乙、丙三种物质的饱和溶液各100g,所需水的质量最少的是____(填“甲”、“乙”或“丙”);
(5)20℃,配制一定量丙物质的溶液,将溶液升温到40℃,是否有固体析出?____(填“有”,“没有”或“不确定”)。
【答案】乙>甲>丙 降温结晶 不饱和 甲 不确定
【解析】
(1)根据溶解度曲线可知,30℃时,甲、乙、丙三种物质的溶解度由大到小的顺序是乙>甲>丙;
(2) 根据溶解度曲线可知,甲的溶解度受温度影响较大,当甲中混有少量的乙时,可采用降温结晶方法提纯甲;
(3)30℃时,甲的溶解度接近30g,若将10g甲物质加入到盛有50g水的烧杯中,充分溶解后,所得溶液是不饱和溶液;
(4)50℃时,甲、乙、丙三种物质的溶解度由大到小的顺序是甲>乙>丙;饱和溶液溶质质量分数由大到小依次是甲、乙、丙,配制三种物质的饱和溶液相等质量均为100g,所需水的质量最少的是甲;
(5)根据溶解度曲线,丙的溶解度随温度升高而减小,若想判断升温过程是否有固体析出,需要知道溶液是否饱和,而题干没有指明,故填:不确定。


科目:初中化学 来源: 题型:
【题目】钢铁是重要的金属材料,在生产、生活中有广泛的用途。建造北京奥运会主体育场“鸟巢”,就是用了大量的钢铁。
(1)每年世界上钢铁的产量很高,钢铁的锈蚀也给人类带来了巨大的损失。铁在空气中锈蚀,实际上是铁跟空气中的_____和_____共同作用的结果;
(2)为了防止钢铁锈蚀,人们常采用在其表面涂刷矿物油或镀上其他金属等覆盖保护膜的方法。这些方法都能防止锈蚀的共同原理是_____;
(3)炼铁厂常以焦炭、赤铁矿(主要成分是氧化铁)空气等为主要原料炼铁,反应过程如下:请写出第②步反应的化学方程式:_____。
![]()
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】2月20日在京举行的国务院联防联控机制新闻发布会上,中国疾控中心研究员冯录召表示,新冠肺炎COVID-19病毒通过污染衣物感染人的机率极低。如果不是去过医院等特定场所,探视过病人或者接触过可疑症状人员,普通公众不需要对衣服专门酒精消毒。冯录召介绍,酒精对普通衣物没有腐蚀作用,但酒精是甲类易燃物品,如果喷洒在衣物上,遇到高温、明火、静电都可能起火,所以建议不要将酒精喷洒在衣服上。

(1)酒精的学名叫乙醇,是一种有机物,化学式为_____,在常温、常压下是无色透明液体,有刺激性的醇香味,是酒类饮品的主要成分。
(2)乙醇液体密度是0.789g/cm3(20℃),能与水以任意比互溶,也是良好的有机溶剂。在自制酸碱指示剂过程中需要添加酒精溶液,添加酒精溶液的作用是_____。
(3)75%(体积分数)的酒精常用于医疗消毒,因其在遇到高温、明火、静电时都可能起火,所以使用时要特别小心;若正在喷出的酒精遇明火燃烧更剧烈,甚至产生爆燃,产生爆燃的原因是_____。
(4)酒精是以农作物的秸秆或粮食为原料,通过微生物的发酵而制得,因此酒精属于_____(填“可再生”或“不可再生”)能源。发酵得到的酒精可以用来酿制白酒,但工业酒精因含少量的甲醇(CH3OH)而不能制酒。甲醇有毒,其它的性质与乙醇十分相似,很难除去,工业酒精往往用来做燃料,写出甲醇燃烧的化学方程式_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲乙两种不含结晶水的固体物质的溶解度曲线如下图,下列说法正确的是()
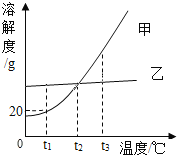
A.甲的溶解度比乙大
B.t1℃时,100g甲的饱和溶液中的溶质的质量是20g
C.t2℃时,甲乙的两种饱和溶液中的溶质的质量分数相等
D.将等质量甲乙的两种溶液分别由t3℃降温至t2℃,析出的甲的质量一定比析出的乙的质量大
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室有一瓶标签受损的无色溶液(标签如图所示)。同学们决定对其成分进行探究。他们首先向老师请教,老师告诉他们初中化学实验室中的含钠化合物可能是NaOH、NaCl、Na2SO4、NaNO3、Na2CO3、NaHCO,并给出相关资料,让同学们结合所学知识进行探究。
![]()
(相关资料)(1)NaOH、Na2CO3、NaHCO3的溶液呈碱性,NaCl、Na2SO4、NaNO3的溶液呈中性。
(2)NaHCO3属于可溶物质(室温下溶解度小于10g),而其它物质属于易溶物质(室温下溶解度大于10g)。
(交流讨论)同学们一致认为该溶液一定不是NaHCO3溶液,他们的理由是____。
(实验探究)为确定该溶液的成分,同学们进行了如下实验。
步骤 | 实验操作 | 实验现象 | 实验结论 |
Ⅰ | 用玻璃棒蘸取溶液滴到pH试纸上,把试纸显示的颜色与____进行比较 | 试纸条变蓝 | 该溶液的pH=10,通过比较。可能是____。 |
Ⅱ | 取少量溶液于试管中向其中滴加足量的稀盐酸。 | ____ | 该溶液为Na2CO3溶液。有关反应的化学方程式为____。 |
(反思评价)老师指出该结论不严密。理由是若该溶液为NaOH溶液,在空气中发生变质,也能产生上述现象。请写出NaOH在空气中变质反应的化学方程式:____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】寒假期间,某兴趣小组同学对“锌与硫酸反应快慢的影响因素”进行探究。
[提出问题] 锌与硫酸反应的快慢与哪些因素有关?
[猜想假设](1)a、可能与锌的形状、颗粒大小有关;
b、可能与硫酸的质量分数大小有关;
c、还可能与______有关。
[设计与实验] 以3分钟内收集到的氢气体积作为判断依据,具体如下表所示:
实验 编号 | 锌的形状 (均取1 g) | 硫酸的浓度 (均取20 mL) | 氢气的体积 (/mL) |
① | 锌粒 | 20% | 31.7 |
② | 锌片 | 20% | 50.9 |
③ | 锌粒 | 30% | 61.7 |
④ | 锌片 | 30% |
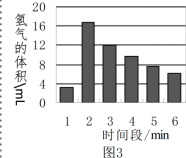
[比较分析](2)要验证猜想a ,可选择的实验编号是_______________。
(3)实验④由于没有及时记下数据,经同学回忆,你认为比较可能的数值是__________(填“57.5”或“75.5”)。
[得出结论](4)完成实验①②③后,可以得出影响该反应快慢的一条结论是:________。
[反思评价] 图3是用实验①来测定,在每一分钟内收到氢气的体积变化图,请
(5)第1分钟时间内反应的速率较慢,这是由于锌粒表面有些氧化膜(ZnO)覆盖,则其原因用化学方程式表示为______。
(6)从第3分钟开始,反应的速率又逐渐变______,这是因为______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】对比学习有利于发现事物的共性与个性。为探究酸的性质,同学们进行了如下实验。
实验内容 | 实验现象 | 分析与结论 |
| 醋酸晶体试管内___,醋酸溶液试管中镁带表面冒气泡。 | 酸的很多反应通常在水溶液中才能完成。 |
用玻璃棒蘸硫酸在白纸上写字 | _______(填“浓”或“稀”)硫酸使白纸炭化。 | 即使是同种酸,由于____不同,它们的性质不完全相同。 |
| 两试管中均产生_____ | 不同的酸具有相似的性质,这是因为酸的组成中都含有_____(填元素符号)。 |
| E试管中产生_____, F试管中无明显现象。 | 不同的酸根会导致酸的“个性”差异。因此,可用氯化钡溶液鉴别盐酸和硫酸。 |
清洗试管时,小乔同学将C、F两试管中的无色液体同时倒入一个洁净的废液缸,废液缸中立刻冒气泡并出现白色沉淀。请分析上述现象并回答:
Ⅰ.废液缸中产生气体的化学方程式为______。
Ⅱ. 废液缸里最终产生的白色沉淀中一定有硫酸钡,可能有____(填化学式)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是三种物质的溶解度曲线。请回答:
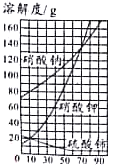
(1)溶解度随温度升高而降低的是_______;30℃时溶解度最大的是_______。
(2)80℃时硝酸钠饱和溶液的溶质质量分数为_______。不饱和溶液变为饱和溶液,可采取的措施有_______(写一种)。
(3)某硝酸钾固体中混有少量硫酸铈杂质,分离提纯硝酸钾的操作是:配成高温下的硝酸钾饱和溶液、_______、过滤、洗涤、干燥。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com