
【题目】Ⅰ.能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
已知:C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1
H2(g)+![]() O2(g)===H2O(g) ΔH2=-241.8 kJ·mol-1
O2(g)===H2O(g) ΔH2=-241.8 kJ·mol-1
CO(g)+![]() O2(g)===CO2(g) ΔH3=-283.0 kJ·mol-1
O2(g)===CO2(g) ΔH3=-283.0 kJ·mol-1
则煤气化主要反应C(s)+H2O(g)=CO(g)+H2(g)的ΔH=____________________。
Ⅱ.为了减少CO的排放,某环境研究小组以CO和H2为原料合成清洁能源二甲醚(DME),反应如下:4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g) ΔH=-198 kJ·mol-1。
CH3OCH3(g)+H2O(g) ΔH=-198 kJ·mol-1。
(1)如图所示能正确反映平衡常数K随温度变化关系的曲线为________(填曲线标记字母),其判断理由是____________。

(2)在一定温度下,向2.0 L固定容积的密闭容器中充入2 mol H2和1 mol CO,经过一段时间后,反应4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g)达到平衡。反应过程中测得的部分数据见下表:
CH3OCH3(g)+H2O(g)达到平衡。反应过程中测得的部分数据见下表:
时间/min | 0 | 20 | 40 | 80 | 100 |
n(H2)/mol | 2.0 | 1.4 | 0.85 | 0.4 | — |
n(CO)/mol | 1.0 | — | 0.425 | 0.2 | 0.2 |
n(CH3OCH3)/mol | 0 | 0.15 | — | — | 0.4 |
n(H2O)/mol | 0 | 0.15 | 0.2875 | 0.4 | 0.4 |
①0~20 min的平均反应速率v(CO)=__________________mol·L-1·min-1;
②达到平衡时,H2的转化率为__________________;
③在上述温度下,该反应的平衡常数K=______________________;
④能表明该反应达到平衡状态的是________(填序号);
A CO的转化率等于H2O的产率 B 混合气体的平均相对分子质量不变
C v(CO)与v(H2)的比值不变 D 混合气体的密度不变
⑤在上述温度下,向平衡后的2 L容器中再充入0.4 mol H2和0.4 mol CH3OCH3(g),则化学平衡________移动(填“向左”“向右”或“不”)。
【答案】+131.3 kJ·mol-1 a 正反应放热,温度升高平衡常数减小 0.0075 80% 2500 B 向右
【解析】
Ⅰ.根据盖斯定律计算;
Ⅱ. (1)4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g) ΔH=-198 kJ·mol-1,升高温度平衡逆向移动;
CH3OCH3(g)+H2O(g) ΔH=-198 kJ·mol-1,升高温度平衡逆向移动;
(2)①v(CO)=Δc(CO)/Δt;
②H2的平衡转化率=氢气浓度的变化量/初始量×100%;
③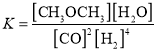 ;
;
④根据平衡标志判断;
⑤根据Q与K的关系判断平衡移动方向。
Ⅰ.①C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1
②H2(g)+![]() O2(g)===H2O(g) ΔH2=-241.8 kJ·mol-1
O2(g)===H2O(g) ΔH2=-241.8 kJ·mol-1
③CO(g)+![]() O2(g)===CO2(g) ΔH3=-283.0 kJ·mol-1
O2(g)===CO2(g) ΔH3=-283.0 kJ·mol-1
根据盖斯定律,①―②―③得C(s)+H2O(g)=CO(g)+H2(g)的ΔH=+131.3 kJ·mol-1。
Ⅱ. (1)4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g) ΔH=-198 kJ·mol-1,升高温度平衡逆向移动,K值减小,能正确反映平衡常数K随温度变化关系的曲线为a;
CH3OCH3(g)+H2O(g) ΔH=-198 kJ·mol-1,升高温度平衡逆向移动,K值减小,能正确反映平衡常数K随温度变化关系的曲线为a;
(2)①在0~20 min内Δn(CO)=Δn(H2)/2=0.5×(2.0 mol-1.4 mol)=0.3 mol,v(CO)=Δc(CO)/Δt=0.15mol/L÷20 min=0.0075 mol·L-1·min-1。
②平衡时,Δn(H2)=2.0 mol-0.4 mol=1.6 mol,则转化率α(H2)=1.6mol/2mol×100%=80%。
③根据化学反应:
4H2(g)+2CO(g)=CH3OCH3(g)+H2O(g)
起始浓度(mol/L) 1.0 0.5 0 0
转化浓度(mol/L) 0.8 0.4 0.2 0.2
平衡浓度(mol/L) 0.2 0.1 0.2 0.2
![]() =2500。
=2500。
④A、CO的转化率和H2O的产率表示的都是正反应方向,不能说明v正=v逆,A项错误;
B、混合气体的平均相对分子质量=m/n,在反应过程中气体的总质量不变、总物质的量是变量,则平均相对分子质量是变量,若平均相对分子质量不变说明反应已达到平衡,B项正确;
C、v(CO)与v(H2)的比值不变,不能说明v正=v逆,故不能表明该反应达到平衡状态,C项错误;
D、混合气体的密度ρ=m/V,因为混合气体总质量不变,容器容积V不变,故密度始终不变,D项错误。
⑤Qc=![]() =312.5<2500,化学平衡向右移动。
=312.5<2500,化学平衡向右移动。


科目:高中化学 来源: 题型:
【题目】向盛有KMnO4溶液的试管中加入过量的MnSO4溶液,产生黑色沉淀,溶液由紫红色变为无色;过滤,向滤液中加入少量的铋酸钠(NaBiO3)粉末,溶液又变为紫红色。下列推断错误的是
A.氧化性:NaBiO3>KMnO4>MnO2
B.生成8.7g黑色沉淀,转移0.2mol电子
C.利用NaBiO3可以检验溶液中的Mn2+
D.NaBiO3可与浓盐酸发生反应:NaBiO3+6HC1=BiCl3+Cl2↑+NaCl+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2NO2![]() 2NO+O2在恒容密闭容器中反应,不能判断此反应达到最大限度的标志是( )
2NO+O2在恒容密闭容器中反应,不能判断此反应达到最大限度的标志是( )
A. 单位时间内生成n mol O2 的同时,生成2n molNO2 B. 混合气体的平均相对分子质量不再改变
C. 混合气体的颜色不再改变 D. NO2, NO, O2的速率之比是2:2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】王浆酸是从蜂王浆中分离出的一种有机酸,它有很好的杀菌、抗癌、抗放射及强化机体、增强免疫力的作用,其结构如下所示。有关王浆酸的说法不正确的是( )
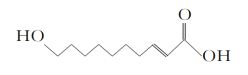
A. 分子式为C10H18O3
B. 能使溴的四氯化碳溶液褪色
C. 一定条件下能发生取代反应和氧化反应
D. 1 mol王浆酸最多能中和2 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
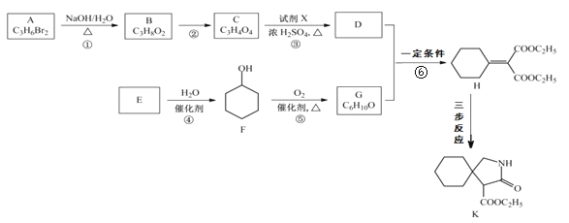
【题目】有机物 K 是某药物的中间体,合成路线如图所示:
已知:i.R-CN![]() R-CH2-NH2
R-CH2-NH2
ii.R1-NH2+R2COOC2H5![]()
![]() +C2H5OH
+C2H5OH
回答下列问题
(1)A 的名称是_______。
(2)反应①的化学方程式是_____。
(3)反应②的类型是_____。
(4)反应③中的试剂 X是_____。
(5)E 属于烃,其结构简式是_____。
(6)H 中所含的官能团是_____。
(7)反应⑥的化学方程式是_____。
(8)H 经三步反应合成 K:H![]() I→J→K,写出中间产物 I和J的结构简式_____。
I→J→K,写出中间产物 I和J的结构简式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种高效净水剂。已知:K2FeO4易溶于水,其溶液呈紫色、微溶于浓KOH溶液,在0℃~5℃的强碱性溶液中较稳定。某小组同学用下图装置制备并探究K2FeO4的性质。制备原理:3Cl2+2Fe(OH)3+10KOH=2K2FeO4+6KCl+8H2O,装置如图所示(夹持装置略)。
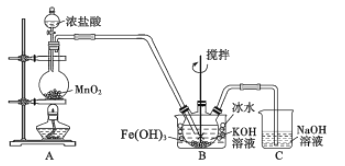
(1)盛放二氧化锰的仪器名称___________________,装置C的作用是____________________。
(2)装置A 中反应的化学方程式是________________________________________。
(3)实验时采用冰水浴的原因是________________,此装置存在一处明显缺陷,请指出___________。
(4)K2FeO4粗产品含有Fe(OH)3、KCl等杂质,一般用75%乙醇进行洗涤,其目的是_________。
(5)查阅资料知,K2FeO4能将 Mn2+氧化成 MnO4-。该小组设计如下实验进行验证:
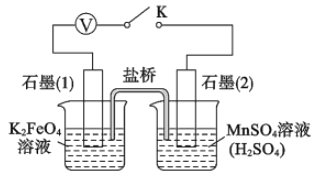
关闭K,左烧杯溶液变黄色,右烧杯溶液变紫色。检验左侧烧杯溶液呈黄色的原因,需要的试剂是_______;写出上图中负极的电极反应式: _________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某浓度的氨水中存在下列平衡:NH3·H2O![]() NH4++OH-,若想增大NH4+的浓度,而不增大OH-的浓度,应采取的措施是( )
NH4++OH-,若想增大NH4+的浓度,而不增大OH-的浓度,应采取的措施是( )
A. 适当升高温度B. 加入NaCl固体C. 加入少量盐酸D. 通入NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如右图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是( )

A. 上下移动①中铜丝可控制SO2的量
B. ②中选用品红溶液验证SO2的生成
C. ③中选用NaOH溶液吸收多余的SO2
D. 为确认CuSO4生成,向①中加水,观察颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莽草酸可用于合成药物达菲,莽草酸的结构简式如图所示。下列关于莽草酸的说法正确的是( )
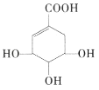
A.分子式为![]() B.分子中含有2种官能团
B.分子中含有2种官能团
C.可发生加成反应和取代反应D.1mol莽草酸与足量的Na反应,标况下生成33.6LH2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com