
【题目】高铁酸钾(K2FeO4)是一种高效净水剂。已知:K2FeO4易溶于水,其溶液呈紫色、微溶于浓KOH溶液,在0℃~5℃的强碱性溶液中较稳定。某小组同学用下图装置制备并探究K2FeO4的性质。制备原理:3Cl2+2Fe(OH)3+10KOH=2K2FeO4+6KCl+8H2O,装置如图所示(夹持装置略)。

(1)盛放二氧化锰的仪器名称___________________,装置C的作用是____________________。
(2)装置A 中反应的化学方程式是________________________________________。
(3)实验时采用冰水浴的原因是________________,此装置存在一处明显缺陷,请指出___________。
(4)K2FeO4粗产品含有Fe(OH)3、KCl等杂质,一般用75%乙醇进行洗涤,其目的是_________。
(5)查阅资料知,K2FeO4能将 Mn2+氧化成 MnO4-。该小组设计如下实验进行验证:
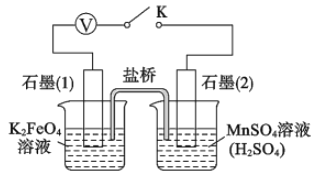
关闭K,左烧杯溶液变黄色,右烧杯溶液变紫色。检验左侧烧杯溶液呈黄色的原因,需要的试剂是_______;写出上图中负极的电极反应式: _________。
【答案】圆底烧瓶 吸收多余的氯气,防止污染环境 MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O K2FeO4在0℃~5℃环境中稳定,防止副反应发生 缺少除Cl2中混有的HCI的装置 减少产品损失,易于干燥 硫氰酸钾溶液(KSCN溶液) Mn2++4H2O-5e-=MnO4-+ 8H+
MnCl2+Cl2↑+2H2O K2FeO4在0℃~5℃环境中稳定,防止副反应发生 缺少除Cl2中混有的HCI的装置 减少产品损失,易于干燥 硫氰酸钾溶液(KSCN溶液) Mn2++4H2O-5e-=MnO4-+ 8H+
【解析】
(1)根据装置图回答盛放二氧化锰的仪器名称;NaOH溶液能吸收多余的氯气;
(2)装置A 中二氧化锰与浓盐酸在加热条件下生成氯化锰、氯气和水;
(3)根据K2FeO4在0℃~5℃的强碱性溶液中较稳定回答;装置A制备的氯气中含有杂质氯化氢;
(4)根据K2FeO4易溶于水、难溶于无水乙醇分析;
(5)左烧杯溶液变黄色说明K2FeO4被还原为Fe3+;负极是Mn2+失电子被氧化为MnO4-。
(1)根据装置图,盛放二氧化锰的仪器名称是圆底烧瓶;NaOH溶液能吸收多余的氯气,所以装置C的作用是吸收多余的氯气,防止污染环境。
(2)装置A 中二氧化锰与浓盐酸反应生成氯化锰、氯气和水,反应的化学方程式是MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(3)K2FeO4在0℃~5℃环境中稳定,实验时采用冰水浴可以防止副反应发生。装置A制备的氯气中含有杂质氯化氢,此装置缺少除Cl2中混有的HCI的装置;
(4)K2FeO4易溶于水、难溶于无水乙醇,用75%乙醇进行洗涤,可以减少产品损失、易于干燥;
(5)左烧杯溶液变黄色说明K2FeO4被还原为Fe3+,Fe3+遇硫氰酸钾溶液变为血红色,检验左侧烧杯溶液呈黄色原因的试剂是硫氰酸钾溶液;负极是Mn2+失电子被氧化为MnO4-,负极反应式是Mn2++4H2O-5e-=MnO4-+ 8H+。


科目:高中化学 来源: 题型:
【题目】如图所示表示一些晶体中的某些结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨结构中的某一种的某一部分:
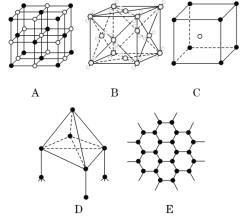
(1)代表金刚石的是(填编号字母,下同)____,其中每个碳原子与____个碳原子最接近且距离相等;
(2)代表石墨的是______,每个正六边形占有的碳原子数平均为____个;
(3)代表NaCl的是_______ ,代表CsCl的是_____,每个Cs+与____个Cl-紧邻。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃以任意比例混合,在105℃时1 L该混合烃与9 L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10 L。下列各组混合烃中不符合此条件的是 ( )
A. CH4 C3H6 B. CH4 C2H4 C. C2H4 C3H4 D. C2H2 C3H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA为阿伏加德罗常数的值,下列说法正确的是( )
A.常温下2.2gCO2中含有共用电子对的数目为2NA
B.18g D2O中含有的电子总数为10NA
C.在常温下,4.4g的CO2和N2O混合气体所含的原子数一定是0.3NA
D.1 mol Na2O2所含阴离子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
已知:C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1
H2(g)+![]() O2(g)===H2O(g) ΔH2=-241.8 kJ·mol-1
O2(g)===H2O(g) ΔH2=-241.8 kJ·mol-1
CO(g)+![]() O2(g)===CO2(g) ΔH3=-283.0 kJ·mol-1
O2(g)===CO2(g) ΔH3=-283.0 kJ·mol-1
则煤气化主要反应C(s)+H2O(g)=CO(g)+H2(g)的ΔH=____________________。
Ⅱ.为了减少CO的排放,某环境研究小组以CO和H2为原料合成清洁能源二甲醚(DME),反应如下:4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g) ΔH=-198 kJ·mol-1。
CH3OCH3(g)+H2O(g) ΔH=-198 kJ·mol-1。
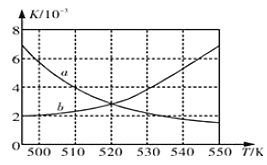
(1)如图所示能正确反映平衡常数K随温度变化关系的曲线为________(填曲线标记字母),其判断理由是____________。
(2)在一定温度下,向2.0 L固定容积的密闭容器中充入2 mol H2和1 mol CO,经过一段时间后,反应4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g)达到平衡。反应过程中测得的部分数据见下表:
CH3OCH3(g)+H2O(g)达到平衡。反应过程中测得的部分数据见下表:
时间/min | 0 | 20 | 40 | 80 | 100 |
n(H2)/mol | 2.0 | 1.4 | 0.85 | 0.4 | — |
n(CO)/mol | 1.0 | — | 0.425 | 0.2 | 0.2 |
n(CH3OCH3)/mol | 0 | 0.15 | — | — | 0.4 |
n(H2O)/mol | 0 | 0.15 | 0.2875 | 0.4 | 0.4 |
①0~20 min的平均反应速率v(CO)=__________________mol·L-1·min-1;
②达到平衡时,H2的转化率为__________________;
③在上述温度下,该反应的平衡常数K=______________________;
④能表明该反应达到平衡状态的是________(填序号);
A CO的转化率等于H2O的产率 B 混合气体的平均相对分子质量不变
C v(CO)与v(H2)的比值不变 D 混合气体的密度不变
⑤在上述温度下,向平衡后的2 L容器中再充入0.4 mol H2和0.4 mol CH3OCH3(g),则化学平衡________移动(填“向左”“向右”或“不”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质在水溶液中的电离方程式正确的是
A. NaHCO3:NaHCO3![]() HCO3-+ Na+
HCO3-+ Na+
B. NaHSO4:NaHSO4=Na+ +HSO4-
C. CH3COONH4:CH3COONH4=NH4++CH3COO-
D. Fe(OH)3:Fe(OH)3![]() Fe(OH)2++2OH-
Fe(OH)2++2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)写出下列仪器的名称

② _____________③____________④________________
(2)分离出碘水中的碘应先选择装置____________(填I、II、III) 进行操作;
该分离提纯的方法叫_____________ ;
进行该操作,需加一试剂,在选择试剂时,下列性质你认为哪些性质是必需的:____________(填序号)
①与碘水不反应 ②I2在其中溶解程度大于在水中的溶解度 ③与水不相容 ④密度要比水小
如果选择苯C6H6(是一种密度比水小的有机溶剂)作这种试剂,现象是________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲测定某NaOH溶液的物质的量浓度,可用0.1000mol/L的HCl标准溶液进行中和滴定(用甲基橙作指示剂)。 请回答下列问题:
(1)滴定前,用移液管量取待测NaOH溶液于 _____中( 填仪器名称),并加入2~3滴指示剂;
(2)盛装标准盐酸的仪器名称为 _____ ;
(3)如何判断滴定终点(需写出颜色变化) __________ ;
某学生做了三组平行实验,数据记录如下:
(4)选取下述合理数据,算出待测NaOH溶液的物质的量浓度为 ___________;(保留四位有效数字)
实验序号 | 待测NaOH溶液的体积/ mL | 0.1000mol.L-1HCl溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.00 | 26.29 |
2 | 25.00 | 1.00 | 31.00 |
3 | 25.00 | 1.00 | 27.31 |
(5)下列哪些操作会使测定结果偏低____________。
a.反应容器用蒸馏水洗净后,未用待测液润洗
b.滴定前,平视读数;滴定后,仰视读数
c.滴定前,尖嘴无气泡;滴定后,尖嘴出现气泡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图为元素在生物体内的含量分布情况,下列表述错误的是

A. P、S、K、Ca、Zn属于大量元素
B. 在非生物界中都能找到,体现生物界与非生物界的统一性
C. Ⅱ和Ⅲ为生物体的必需元素,一旦缺乏就可能会导致相应的病症
D. Ⅲ含量虽少,却是生物体正常生命活动不可缺少的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com