
【题目】医用酒精和84消毒液混合使用可能发生反应:4NaClO+CH3CH2OH![]() HCCl3+HCOONa+NaCl+2NaOH+H2O,设NA为阿伏加德罗常数,下列叙述正确的是
HCCl3+HCOONa+NaCl+2NaOH+H2O,设NA为阿伏加德罗常数,下列叙述正确的是
A.含NA个ClO-的NaClO溶液中,Na+数目为NA
B.上述反应中,每生成1molNaCl,转移的电子数为8NA
C.100 g质量分数为46%的乙醇溶液中所含的氢原子数为6NA
D.标准状况下,2.24 L HCCl3含有的共用电子对的数目为0.4NA
科目:高中化学 来源: 题型:
【题目】室温下,用0.100mol/L NaOH溶液分别滴定20.00mL 0.100mol/L的盐酸和醋酸。下列说法正确的是
A.起始时盐酸和醋酸溶液的pH相同
B.V(NaOH)=10.00mL时,醋酸溶液中,![]()
C.恰好中和时,两种酸所用NaOH溶液体积不相等,醋酸用的体积少
D.V(NaOH)=20.00mL时,c(Cl-)>c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿(主要成分为Al2O3,还有MgO等少量杂质)。提取铝的工业流程如下:
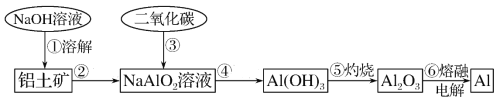
(1)铝是活泼金属,在干燥空气中铝的表面立即形成厚约5nm的致密氧化膜,写出用盐酸除去氧化膜的化学方程式___。
(2)氢氧化铝是用量最大、应用最广的无机阻燃添加剂,解释氢氧化铝能做阻燃剂的原因______(用方程式说明),写出第②步用到的玻璃仪器______。
(3)请用离子方程式表示以上工艺流程中第①步反应:__。
(4)实验室常选用试剂__(填写字母,a.氢氧化钠溶液,b.氨水)与硫酸铝溶液反应制取氢氧化铝,原因是__。
(5)写出氢氧化铝的其他用途(任写两条)__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若4.6 g Na在足量氧气中一段时间后,生成固体的质量为7.1 g,则生成的固体可能为( )
A.Na 和Na2OB.Na 和Na2O2C.Na 和Na2O2D.Na2O 和Na2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天青石(主要含有SrSO4和少量CaCO3杂质)是获取锶元素的各种化合物的主要原料。请回答下列问题:
(1)利用焰色反应可以定性鉴别某些金属盐。灼烧SrSO4时,锶的焰色为_____(填标号)。 A.洋红色 B.浅紫色 C.黄绿色 D.淡蓝色
(2)硫化锶(SrS)可用作发光涂料的原料,SrSO4和碳的混合粉末在隔绝空气下高温焙烧可生成硫化锶和一种还原性气体, 该反应的化学方程式____________________________。
(3)已知:25℃时,K sp(SrSO4)=3.2×10-7,K sp(SrCO3)=1.1×10-10。SrSO4的粉末与Na2CO3溶液混合加热、充分搅拌可生成硫酸钠和碳酸锶,若转化完成时恢复到25℃,混合液中c(CO![]() )=1.0×10-3mol/L,则c(SO
)=1.0×10-3mol/L,则c(SO![]() )=______________________。
)=______________________。
(4)以天青石生产Sr(OH)2·xH2O的工艺如下:

已知: Sr(OH)2 、Ca(OH)2在水中的溶解度如下表:
温度/(℃) | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度(g) | Sr(OH)2 | 0.91 | 1.77 | 3.95 | 8.42 | 20.2 | 91.2 |
Ca(OH)2 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 | |
①滤渣2为混有CaCO3的SrCO3,写出反应1生成SrCO3的化学方程式______________。
②固体3 “加热水浸”是为了获得较纯净的Sr(OH)2溶液/span>,此时应缓慢加热使沉淀颗粒长大,滤渣5的主要成分是______(填化学式),“趁热过滤”的目的是_________________________________。
③“操作6”主要有:________________、过滤、洗涤、干燥。
④取m g纯净Sr(OH)2·x H2O产品溶于水,加入过量Na2CO3溶液后过滤、洗涤、干燥后,得到n g滤渣,则x=__________(用含m、n的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
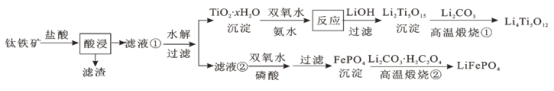
下列说法不正确的是
A.“酸浸”后,若钛主要以TiOCl42-形式存在,则相应反应的离子方程式可表示为:FeTiO3+4H++4Cl- = Fe2++ TiOCl42-+2H2O
B.若Li2Ti5O15中Ti的化合价为+4,则其中过氧键的数目为3个
C.“高温煅烧②”中由FePO4制备LiFePO4的化学方程式可表示为:2FePO4+Li2CO3+H2C2O4![]() 2LiFePO4+H2O+3CO2↑
2LiFePO4+H2O+3CO2↑
温度/ | 30 | 35 | 40 | 45 | 50 |
TiO2 ·xH2O转化率/% | 92 | 95 | 97 | 93 | 88 |
D.TiO2 ·xH2O沉淀与双氧水、氨水反应40min所得实验结果如上表所示, 40 oC前,未达到平衡状态,随着温度升高,转化率变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含硫酸铝和氯化铝的混合溶液中逐滴加入氢氧化钡溶液至过量,加入氢氧化钡溶液的体积和所得沉淀的物质的量的关系如图所示。
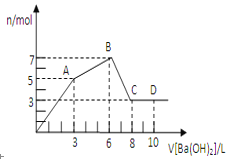
(1)氢氧化钡溶液浓度为_____________________。
(2)原混合溶液中SO42-和Cl-的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向物质Y中逐渐加入(或通入)X溶液,生成沉淀的量与加入X的物质的量关系如图所示,下表中符合图示情况的是
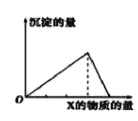
A | B | C | D | |
X | CO2 | HCl | NaOH | AlCl3 |
Y | Ca(OH)2 | NaAlO2 | AlCl3 | NaOH |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铋(Bi)的化合物在电子、医药等领域应用广泛。由辉铋矿(主要成分为Bi2S3, 含杂质SiO2等,Bi2S3不溶于水和硫酸)制备Bi2O3的工艺如下。
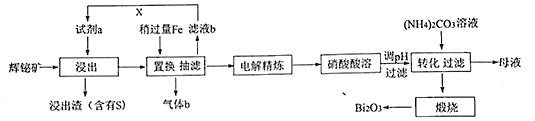
回答下列问题:
(1)试剂a最好选用的试剂是______________(填选项字母);
A. HCl溶液 B.浓H2SO4 C. H2O2溶液 D. FeCl3和HCl混合液
(2)辉铋矿的浸出液中铋元素主要以Bi3+形式存在,写出浸出过程生成S渣的离子方程式_______,“滤液b”中通入气体X后可循环利用,气体X是_______________ (写化学式);
(3)“抽滤”用如下装置完成,请选择字母代号补全正确的操作顺序(洗涤操作只做一次):

开抽气泵→a→b→d→ ____→c→ 关抽气泵;
a.转移固液混合物 b.关活塞A c.开活塞A d.确认抽干 e.加洗涤剂洗涤
(4)写出“煅烧”碱式碳酸铋[(BiO)2CO3]制备Bi2O3 的化学方程式____________________________;
(5)硝酸酸溶后调pH可得到碱式硝酸铋,碱式硝酸铋直接灼烧也能得到Bi2O3,上述工艺中却转化为碱式碳酸铋再灼烧,除了能改良产品性状,另一优点是__________________________________________;
(6)从“母液”中回收可用做炸药的物质是_________ ( 写物质名称)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com