
| 化学式 | CH3COOH | H2C2O4 | H2S |
| 电离平衡常数 | 1.8×10-5 | Ka1=5.4×10-2 Ka2=5.4×10-5 | Ka1=1.3×10-7 Ka2=7.1×10-15 |
分析 (1)电离平衡常数K等于生成物浓度幂之积与反应物浓度幂之积的比;
(2)酸的电离平衡常数越大,该酸的酸性越强;
(3)H2C2O4和少量KOH溶液反应生成草酸氢钾和水;
(4)NaHS溶液与NaHC2O4溶液生成H2S和草酸钠;
(5)①反应所需要的时间与反应速率成反比,反应速率与氢离子浓度成正比;
②反应速率与氢离子浓度成正比;
③生成的氢气相同,根据转移电子守恒判断消耗的锌;
④氢离子浓度越大,反应速率越大;
⑤酸最终电离出氢离子物质的量越少的,锌可能有剩余.
解答 解:(1)电离平衡常数K等于生成物浓度幂之积与反应物浓度幂之积的比,硫化氢第一步电离平衡常数Ka1=$\frac{c({H}^{+}).c(H{S}^{-})}{c({H}_{2}S)}$,
故答案为:Ka1=$\frac{c({H}^{+}).c(H{S}^{-})}{c({H}_{2}S)}$;
(2)酸的电离平衡常数越大,该酸的酸性越强,CH3COOH、H2C2O4、H2S电离平衡常数大小顺序是,则CH3COOH、H2C2O4、H2S酸性强弱顺序是H2C2O4>CH3COOH>H2S,
故答案为:H2C2O4>CH3COOH>H2S;
(3)H2C2O4和少量KOH溶液反应生成草酸氢钾和水,反应方程式为H2C2O4+KOH═KHC2O4+H2O,
故答案为:H2C2O4+KOH═KHC2O4+H2O;
(4)NaHS溶液与NaHC2O4溶液生成H2S和草酸钠,离子方程式为HS-+HC2O4-═H2S+C2O42-,
故答案为:HS-+HC2O4-═H2S+C2O42-;
(5)①反应所需要的时间与反应速率成反比,反应速率与氢离子浓度成正比,反应过程中醋酸继续电离出氢离子,导致氢离子浓度A<B,反应速率A<B,则反应所需时间A>B,故错误;
②反应速率与氢离子浓度成正比,开始时A、B氢离子浓度相等,反应速率A=B,故错误;
③生成的氢气相同,根据转移电子守恒知,消耗的锌A=B,故正确;
④氢离子浓度越大,反应速率越大,反应过程中氢离子浓度A<B,反应过程的平均速率B>A
,故正确;
⑤酸最终电离出氢离子物质的量越少的,锌可能有剩余,两种酸中酸最终电离出的氢离子浓度A<B,则可能A剩余锌,故错误;
故选③④.
点评 本题考查弱电解质的电离,为高频考点,侧重考查学生分析判断能力,明确弱电解质电离平衡常数与电解质强弱关系是解本题关键,注意:反应速率与离子浓度成正比与电解质强弱无关,题目难度不大.


科目:高中化学 来源: 题型:实验题
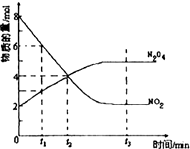 一定温度下,在容积为1L的密闭容器中放入2molN2O4和8molNO2,发生如下反应2NO2(红棕色)═N2O4(无色)△H<0反应中NO2、N2O4的物质的量随反应时间变化的曲线如图,按下列要求作答:
一定温度下,在容积为1L的密闭容器中放入2molN2O4和8molNO2,发生如下反应2NO2(红棕色)═N2O4(无色)△H<0反应中NO2、N2O4的物质的量随反应时间变化的曲线如图,按下列要求作答:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(ClO)2溶液中通入过量的二氧化硫气体:ClO-+SO2+H2O=HClO+HSO3- | |
| B. | 用高锰酸钾溶液滴定草酸:2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O | |
| C. | 稀硝酸中加入过量铁粉:Fe+4H++NO3-=Fe3++NO↑+2H2O | |
| D. | 向碳酸氢钙溶液中加入过量的氢氧化钠溶液:Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.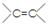 两边基团换位的反应.如两个丙烯分子进行烯烃换位,生成丁烯和乙烯.
两边基团换位的反应.如两个丙烯分子进行烯烃换位,生成丁烯和乙烯.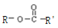 +H2O
+H2O
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOK(固体) | B. | CH3COOH | C. | KCl(固体) | D. | KOH(固体) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.0gH218O与D2O的混合物中所含中子数为NA | |
| B. | 常温常压下,4.4g乙醛所含σ键数目为0.7 NA | |
| C. | 标准状况下,5.6L CO2与足量Na2O2反应转移的电子数为0.5 NA | |
| D. | 50ml 12mol/L盐酸与足量MnO2共热,转移的电子数为0.3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com