
| A. | NaCN水溶液显碱性:CN-+H2O?HCN+OH- | |
| B. | Mg(OH)2固体投人FeCl3溶液中:3Mg(OH)2+2Fe3+=3Mg2++2Fe(OH)3 | |
| C. | Na2S水解:S2-+2H20?H2S+2OH- | |
| D. | H2CO3在水溶液中电离:H2CO3?CO32-+2H+ |
分析 A.NaCN是强碱弱酸盐,氢氰根离子水解导致溶液呈碱性;
B.氯化铁是强酸弱碱盐,铁离子水解导致其水溶液呈酸性,能溶解氢氧化镁生成镁离子和水;
C.硫离子水解分两步,第一步水解程度远远大于第二步水解程度;
D.碳酸是二元弱酸,分两步电离,第一步电离程度远远大于第二步电离程度.
解答 解:A.NaCN是强碱弱酸盐,氢氰根离子水解导致溶液呈碱性,离子方程式为CN-+H2O?HCN+OH-,故A正确;
B.氯化铁是强酸弱碱盐,铁离子水解导致其水溶液呈酸性,能溶解氢氧化镁生成镁离子和水,离子方程式为Mg(OH)2+2H+=2Mg2++2H2O,故B错误;
C.硫离子水解分两步,第一步水解程度远远大于第二步水解程度,其第一步水解离子方程式为S2-+H2O?HS-+OH-,故C错误;
D.碳酸是二元弱酸,分两步电离,第一步电离程度远远大于第二步电离程度,其第一步电离方程式为H2CO3?HCO3-+H+,故D错误;
故选A.
点评 本题考查离子方程式的书写,为高频考点,涉及盐类水解、弱电解质的电离及难溶物的溶解平衡等知识点,侧重考查基本理论及化学用语,知道多元弱酸和多元弱碱电离方程式书写区别,易错选项是B.


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:解答题
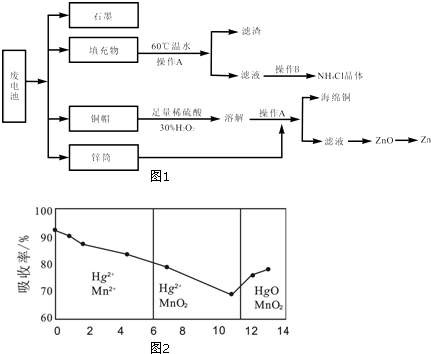
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8:11 | B. | 3:5 | C. | 1:2 | D. | 18:8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2+、K+、Mg2+、NO3- | B. | Na+、Cl-、I-、SO42- | ||
| C. | H2PO4-、NO-3、NH4+、NO3- | D. | S2O32-,AlO2-,Na+,Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
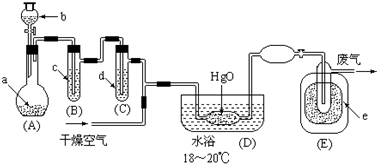
| 化学式 | 熔点(单位:℃) | 沸点(单位:℃) |
| N2 | -209.86 | -195.8 |
| O2 | -218.4 | -183 |
| CO2 | -57 | / |
| NH3 | -77.3 | -33.35 |
| Cl2 | -101 | -34.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
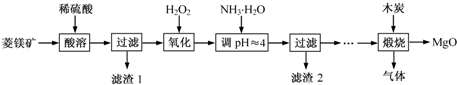

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
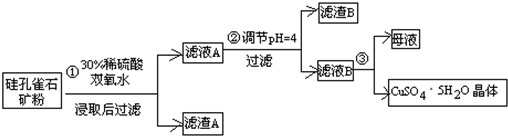
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
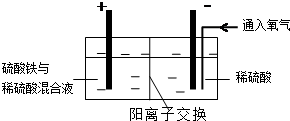
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com