
| A. | Cu2+、K+、Mg2+、NO3- | B. | Na+、Cl-、I-、SO42- | ||
| C. | H2PO4-、NO-3、NH4+、NO3- | D. | S2O32-,AlO2-,Na+,Cl- |
科目:高中化学 来源: 题型:解答题
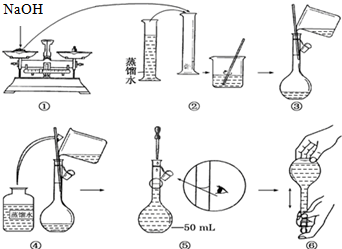
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3+H2O+CO2═Ca(HCO3)2 | B. | AgNO3+NaCl═AgCl↓+NaNO3 | ||
| C. | Na2CO3+Ca(OH)2═CaCO3↓+2NaOH | D. | KCl+NaOH═NaCl+KOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCN水溶液显碱性:CN-+H2O?HCN+OH- | |
| B. | Mg(OH)2固体投人FeCl3溶液中:3Mg(OH)2+2Fe3+=3Mg2++2Fe(OH)3 | |
| C. | Na2S水解:S2-+2H20?H2S+2OH- | |
| D. | H2CO3在水溶液中电离:H2CO3?CO32-+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
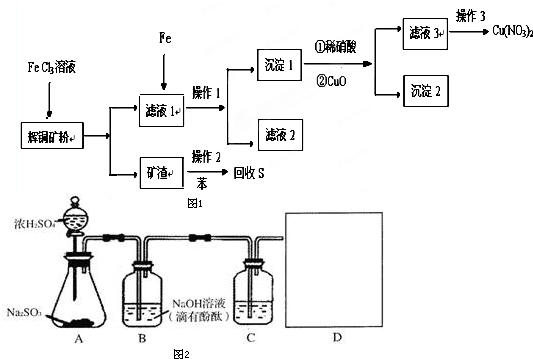
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 物质 | 溶解度/(g/100g水) | ||
| 0°C | 40°C | 80°C | |
| KCl | 28 | 40.1 | 51.3 |
| NaCl | 35.7 | 36.4 | 38 |
| K2Cr2O7 | 4.7 | 26.3 | 73 |
| Na2Cr2O7 | 163 | 215 | 376 |
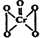 ),该反应可用来检验Cr2O72-的存在.写出反应的离子方程4H2O2+Cr2O72-+2H+═2CrO5+5H2O.该反应不属于(填“属于”或“不属于”)氧化还原反应.
),该反应可用来检验Cr2O72-的存在.写出反应的离子方程4H2O2+Cr2O72-+2H+═2CrO5+5H2O.该反应不属于(填“属于”或“不属于”)氧化还原反应.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
①分离饱和食盐水与沙子的混合物 | ②分离水和汽油的混合物 | ③分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物,CCl4和甲苯互溶 | ④提取出碘水中的碘单质 |
| D | B | C | A |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com