
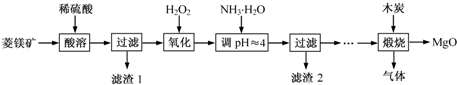

分析 以菱铁矿(主要成分为MgCO3,含少量FeCO3)为原料,加入稀硫酸酸溶过滤得到滤液为硫酸镁,硫酸亚铁溶液,滤渣1为不溶物,滤液中加入过氧化氢氧化亚铁离子为铁离子,加入一水合氨调节溶液PH沉淀铁离子,过滤得到滤渣2为氢氧化铁沉淀,滤液为硫酸镁溶液,蒸发浓缩,冷却结晶,过滤洗涤制备硫酸镁,和木炭高温煅烧制备高纯氧化镁.
(1)碳酸镁与稀硫酸反应生成硫酸镁水和二氧化碳;
(2)过氧化氢在酸性条件下氧化硫酸亚铁为硫酸铁;
(3)煅烧得到的气体主要有SO2、CO2、CO、S,产生的气体进行分步吸收或收集,所以通过A使硫蒸气冷凝下来,再通过B装置高锰酸钾溶液吸收二氧化硫,通过C中的氢氧化钠溶液吸收二氧化碳,最后剩余一氧化碳气体在D中收集.
解答 解:(1)MgCO3与稀硫酸反应生成硫酸镁、二氧化碳和水,化学方程式为:MgCO3+H2SO4═MgSO4+CO2↑+H2O,反应的离子方程式为MgCO3+2H+═Mg2++CO2↑+H2O,
故答案为:MgCO3+2H+═Mg2++CO2↑+H2O;
(2)加入H2O2 氧化时,在酸性溶液中氧化硫酸亚铁为硫酸铁,反应的化学方程式为:2FeSO4+H2O2+H2SO4═Fe2(SO4)3+2H2O,
故答案为:2FeSO4+H2O2+H2SO4═Fe2(SO4)3+2H2O;
(3)煅烧得到的气体主要有SO2、CO2、CO、S,产生的气体进行分步吸收或收集,所以通过A使硫蒸气冷凝下来,再通过B装置高锰酸钾溶液吸收二氧化硫,通过C中的氢氧化钠溶液吸收二氧化碳,最后剩余一氧化碳气体在D中收集;
①D中收集的气体可以是CO,故答案为:CO;
②B中盛放的溶液可以KMnO4溶液吸收二氧化硫,故答案为:d;
③通过C中的氢氧化钠溶液吸收二氧化碳,反应生成碳酸钠和水,反应的离子方程式为:2OH-+CO2=CO32-+H2O,故答案为:2OH-+CO2=CO32-+H2O;
④A中得到的淡黄色固体与热的NaOH溶液反应,依据氧化还原反应原理,产物中元素最高价态为+4,最低价为-2价,反应的离子方程式为:3S+6OH-$\frac{\underline{\;\;△\;\;}}{\;}$2S2-+SO32-+3H2O,故答案为:3S+6OH-$\frac{\underline{\;\;△\;\;}}{\;}$2S2-+SO32-+3H2O.
点评 本题考查了镁、铁及其化合物、二氧化硫性质应用,混合物分离方法和实验操作方法,物质性质熟练掌握是解题关键,题目难度中等.


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCN水溶液显碱性:CN-+H2O?HCN+OH- | |
| B. | Mg(OH)2固体投人FeCl3溶液中:3Mg(OH)2+2Fe3+=3Mg2++2Fe(OH)3 | |
| C. | Na2S水解:S2-+2H20?H2S+2OH- | |
| D. | H2CO3在水溶液中电离:H2CO3?CO32-+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
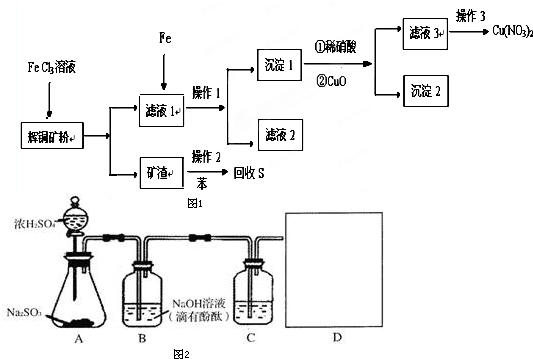
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
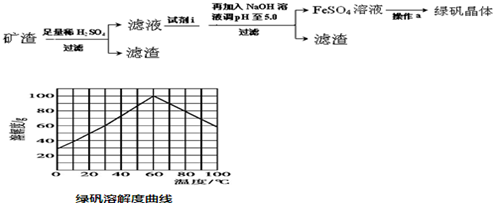
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
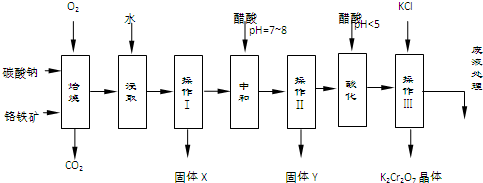
| 物质 | 溶解度/(g/100g水) | ||
| 0°C | 40°C | 80°C | |
| KCl | 28 | 40.1 | 51.3 |
| NaCl | 35.7 | 36.4 | 38 |
| K2Cr2O7 | 4.7 | 26.3 | 73 |
| Na2Cr2O7 | 163 | 215 | 376 |
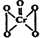 ),该反应可用来检验Cr2O72-的存在.写出反应的离子方程4H2O2+Cr2O72-+2H+═2CrO5+5H2O.该反应不属于(填“属于”或“不属于”)氧化还原反应.
),该反应可用来检验Cr2O72-的存在.写出反应的离子方程4H2O2+Cr2O72-+2H+═2CrO5+5H2O.该反应不属于(填“属于”或“不属于”)氧化还原反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甘油加水作护肤剂 | |
| B. | 蜂、蚁蛰咬处涂抹稀氨水可解痛 | |
| C. | 烹鱼时加入少量的料酒和食醋可减少腥味,增加香味 | |
| D. | 医用酒精可用于皮肤的消毒 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com