
 溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物.某同学依据溴乙烷的性质,用如图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究.
溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物.某同学依据溴乙烷的性质,用如图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究.| 乙醇 |
| △ |
| ||
| △ |
| ||
| △ |
| 乙醇 |
| △ |
| 乙醇 |
| △ |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
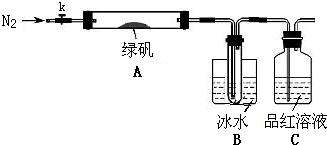 某学习小组拟通过实验探究绿矾(FeSO4?7H2O)热分解的产物.
某学习小组拟通过实验探究绿矾(FeSO4?7H2O)热分解的产物.查看答案和解析>>
科目:高中化学 来源: 题型:
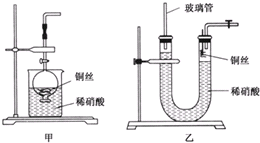
| 浓硝酸 |
| 稀硝酸 |
| 氯气 |
| 硝酸 |
| 空气 |
| 硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
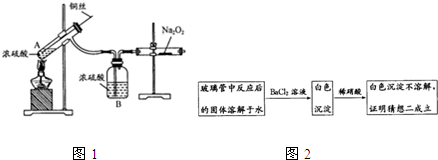
查看答案和解析>>
科目:高中化学 来源: 题型:
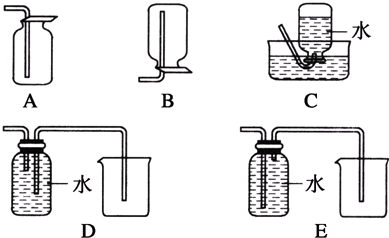
| … | E | A | B | ||
| C | … | D |
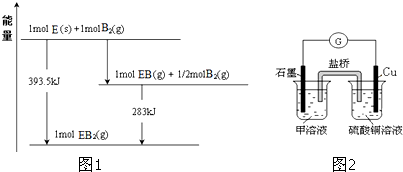
查看答案和解析>>
科目:高中化学 来源: 题型:
A、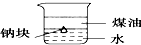 证明ρ(煤油)<ρ(钠)<ρ(水) |
B、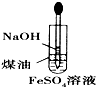 制备Fe(OH)2 |
C、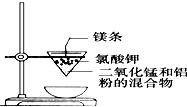 制取金属锰 |
D、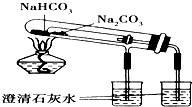 比较NaHCO3和Na2CO3的热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、达到平衡后,降低温度,正向反应速率减小的倍数大于逆向反应速率减小的倍数 |
| B、达到平衡后,升高温度或增大压强都有利于该反应平衡向逆反应方向移动 |
| C、达到平衡时,反应速率v正(X)=2v逆(Z) |
| D、平衡常数K值越大,X的转化率越大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com