
| A. | $\underset{\stackrel{\;}{C}}{•}$H2O | B. | $\underset{\stackrel{\;}{N}}{•}$2H4 | C. | $\underset{\stackrel{\;}{B}}{•}$F3 | D. | $\underset{\stackrel{\;}{C}}{•}$2H4 |
分析 中心原子的杂化类型为sp3,说明该分子中心原子的价层电子对个数是4,价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数,孤电子对个数=$\frac{1}{2}$(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数.
解答 解:A.CH2O分子分子中碳原子含有3个σ键和1个π键,所以C原子采用sp2杂化,故A错误;
B.N2H4分子中每个N原子含有3个σ键和一个孤电子对,所以N原子价层电子对个数是4,则N原子采用杂化sp3,故B正确;
C.BF3中B原子价层电子对个数=3+$\frac{1}{2}$(3-3×1)=3,所以B原子采用sp2杂化,故C错误;
D.乙烯分子中每个C原子含有3个、σ键且不含孤电子对,所以C原子价层电子对个数是3,则C原子采用sp2杂化,故D错误;
故选B.
点评 本题考查了原子杂化方式的判断,根据价层电子对互斥理论来分析解答即可,明确孤电子对个数=$\frac{1}{2}$(a-xb)中各个字母的含义,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 将NaHCO3固体加入新制氯水,有无色气泡(H) | |
| B. | 使红色布条褪色(HCl) | |
| C. | 向氯水中加入CuSO4,变蓝色,(H2O) | |
| D. | 滴加AgNO3溶液生成白色沉淀(Cl) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①②③ | B. | 只有①②③⑤⑥ | C. | 只有①②③⑥ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=7的溶液中,Fe3+、Cl-、Na+、NO3- | |
| B. | 水电离出的[H+]=1×10-3mol/L 的溶液中Na+、CO32-、Cl-、K+ | |
| C. | pH=1的溶液中NH4+、Cl-、Mg2+、SO42-、 | |
| D. | Al3+、HCO3-、I-、Ca2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$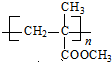 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
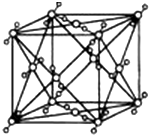 已知A、B、C、D、E都是周期表中的前四周期的元素,它们的核电荷数A<B<C<D<E.其中B、D、E原子最外层电子层的P能级(轨道)上的电子处于半充满状态.通常情况下,A的一种氧化物分子为非极性分子,其晶胞结构如右图所示.原子序数为31的元素镓(Ga)与元素B形成的一种化合物是继以C单质为代表的第一类半导体材料和GaE为代表的第二代半导体材料之后,在近10年迅速发展起来的第三代新型半导体材料.
已知A、B、C、D、E都是周期表中的前四周期的元素,它们的核电荷数A<B<C<D<E.其中B、D、E原子最外层电子层的P能级(轨道)上的电子处于半充满状态.通常情况下,A的一种氧化物分子为非极性分子,其晶胞结构如右图所示.原子序数为31的元素镓(Ga)与元素B形成的一种化合物是继以C单质为代表的第一类半导体材料和GaE为代表的第二代半导体材料之后,在近10年迅速发展起来的第三代新型半导体材料.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
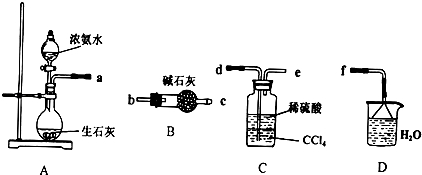 浅绿色的硫酸亚铁铵晶体[又名莫尔盐(NH4)2SO4•FeSO4•6H2O]比绿矾(FeSO4•7H2O)更稳定,常用于定量分析.莫尔盐的一种实验室制法如下:
浅绿色的硫酸亚铁铵晶体[又名莫尔盐(NH4)2SO4•FeSO4•6H2O]比绿矾(FeSO4•7H2O)更稳定,常用于定量分析.莫尔盐的一种实验室制法如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸溶液与NaOH反应:OH-+H+→H2O | |
| B. | 硝酸溶液和碳酸氢钠反应:H++2CO32-→CO2↑+H2O | |
| C. | 将溴水加入KI溶液中:Br2+2I-→I2+2Br- | |
| D. | CO2通入澄清石灰水:2OH-+CO2→H2O+CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com