
| A. | 将NaHCO3固体加入新制氯水,有无色气泡(H) | |
| B. | 使红色布条褪色(HCl) | |
| C. | 向氯水中加入CuSO4,变蓝色,(H2O) | |
| D. | 滴加AgNO3溶液生成白色沉淀(Cl) |
分析 氯气与水反应,发生Cl2+H2O=H++Cl-+HClO,氯水中含有HClO、Cl2,具有氧化性,其中HClO具有漂白性,含有H+,具有酸性,Cl-结合银离子会生成白色沉淀,以此解答.
解答 解:A.氯水显酸性,其中的盐酸能与碳酸氢钠反应生成CO2气体,与氯水成分有关,故A不选;
B.次氯酸具有强氧化性,能氧化有色布条使红色布条褪色,不是HCl的作用,故B选;
C.向氯水中加入CuSO4 ,白色固体硫酸铜溶于水形成蓝色溶液,变蓝色和水有关,故C不选;
D.氯离子和硝酸银反应生成氯化银白色沉淀,与氯水成分有关,故D不选;
故选B.
点评 本题考查氯气的性质,侧重于氯水的组成和性质的考查,为高频考点,难度大不,注意把握相关物质的性质.


科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ④⑤⑥ | C. | ①③④ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 25 | T2 |
| 水的离子积常数 | 1×10-14 | 1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 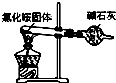 如图是氨气发生装置 | B. | 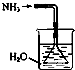 如图是氨气吸收装置 | ||
| C. | 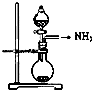 如图是氨气发生装置 | D. | 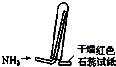 如图是氨气收集、检验装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液时,打开分液漏斗旋转活塞,先放出下层液体,再放出上层液体 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 皮肤不慎沾上NaOH溶液,立即用盐酸冲洗 | |
| D. | 过滤时,为了加快速度,用玻璃棒搅拌悬浊液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 如下表是元素周期表中的前四周期,①~⑨为相应的元素,请从中选择合适的元素回答问题
如下表是元素周期表中的前四周期,①~⑨为相应的元素,请从中选择合适的元素回答问题 | ① | |||||||||||||||||
| ② | ③ | ④ | ⑤ | ⑥ | |||||||||||||
| ⑦ | ⑧ | ⑨ | |||||||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相对原子质量 | B. | 电子层数和核内中子数 | ||
| C. | 电子层数和最外层电子数 | D. | 金属性和非金属性的强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\underset{\stackrel{\;}{C}}{•}$H2O | B. | $\underset{\stackrel{\;}{N}}{•}$2H4 | C. | $\underset{\stackrel{\;}{B}}{•}$F3 | D. | $\underset{\stackrel{\;}{C}}{•}$2H4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com