


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4He原子核内含有4个质子 |
| B、3He和4He互为同位素 |
| C、3He原子核内含有3个中子 |
| D、4He的最外层电子数为2,故 4He具有较强的金属性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示,其中甲、乙、丙、丁、戊分别是氧化铜、稀盐酸、氢氧化钙溶液、碳酸钠溶液、二氧化碳中的一种.图中相连的两圆表示相应物质能发生反应,已知甲和丁反应有气泡出现.则下列说法正确的是( )
如图所示,其中甲、乙、丙、丁、戊分别是氧化铜、稀盐酸、氢氧化钙溶液、碳酸钠溶液、二氧化碳中的一种.图中相连的两圆表示相应物质能发生反应,已知甲和丁反应有气泡出现.则下列说法正确的是( )| A、甲与丙反应属于中和反应 |
| B、乙和戊都是氧化物 |
| C、丙与丁反应会生成白色沉淀 |
| D、丁和戊反应属于化合反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
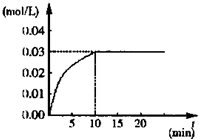 在某一容积为5L的密闭容器内,加入3mol的CO和0.3mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H>0,反应中CO2的浓度随时间变化情况如图:
在某一容积为5L的密闭容器内,加入3mol的CO和0.3mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H>0,反应中CO2的浓度随时间变化情况如图:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com