
【题目】化学镀铜废液中含有一定量的CuSO4,任意排放会污染环境,利用电化学原理可对废液进行回收处理,装置如图,其中质子交换膜只允许H+通过。已知:①Cu2++ HCHO + 3OH-=Cu + HCOO-+ 2H2O;②还原性:HCHO > M(—种金属)> Cu。
下列说法正确的是
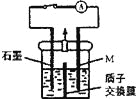
A. 反应之前,应将含OH-的HCHO溶液加入到装置的左侧
B. 右侧发生的电极反应式:HCHO-2e-+H2O=HCOO-+3H+
C. 若将质子交换膜换成阴离子交换膜,放电过程中,大量的OH-将向左侧迁移
D. 放电一段时间后打开开关,移去质子交换膜,装置中可能会有红色固体、蓝色絮状物出现
【答案】D
【解析】
该装置为原电池,M为负极,石墨为正极。
A、根据②HCHO > M(—种金属)> Cu可知,为防止M与镀铜废液中的Cu2+发生反应生成新的金属离子污染环境,应将镀铜废液加入到装置的左侧,则将含OH-的HCHO溶液加入到装置的右侧,A错误;
B、右侧发生反应的电极反应式为HCHO+2OH--2e-=HCOO-+H2O,B错误;
C、若将质子交换膜换成阴离子交换膜,则放电过程中,大量的OH-将向原电池的负极迁移,即向右侧迁移,C错误;
D、若移去质子交换膜,Cu2++ HCHO + 3OH-=Cu + HCOO-+ 2H2O有红色沉淀,Cu2+和OH-结合生成Cu(OH)2蓝色絮状沉淀,D正确。
故选D。


科目:高中化学 来源: 题型:
【题目】利用“化学计量在实验中的应用”的相关知识填空。
(1)含有6.02×1023个氧原子的H2SO4的物质的量是___________。
(2)与标准状况下V LCO2所含氧原子数目相同的水的质量是___________g(用分式表示)
(3)设NA为阿伏加德罗常数的数值,如果a g氧气中含有的分子数为b,则c g氧气在标准状况下的体积约是________(用含NA的式子表示)。
(4)将4 g NaOH溶解在水中配成10 mL溶液,再稀释成1 L,从中取出10 mL,这10 mL溶液的物质的量浓度为_______。
(5)体积比为1∶2∶3的氯化钠、氯化镁和氯化铝溶液,分别加入等体积、等浓度的硝酸银溶液,均恰好完全反应生成氯化银沉淀,则这三种溶液的物质的量浓度之比为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应4CuO![]() 2Cu2O+O2↑,其中Cu2O和CuO中氧元素的化合价均为-2价。关于该反应的叙述正确的是
2Cu2O+O2↑,其中Cu2O和CuO中氧元素的化合价均为-2价。关于该反应的叙述正确的是
A. O2是还原产物
B. 铜元素被还原,氧元素部分被氧化
C. Cu2O是氧化剂
D. 该反应中每生成1个O2,则转移2个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验需要物质的量浓度为0.5mol/L的NaOH溶液960mL用于酸碱中和实验,配制NaOH溶液的步骤如下,回答下列问题:
第一步:称取NaOH固体,加入适量蒸馏水溶解;
第二步:待冷却后转移至容量瓶中;
第三步:用蒸馏水洗涤烧杯和玻璃棒2~3次,将洗涤液也注入容量瓶中;
第四步:定容
第五步:摇匀。
(1)第一步中称量NaOH固体的质量为____g;
(2)第四步“定容”的具体操作为____;
(3)如果配制溶液过程中出现下列情况会对所配制的溶液物质的量浓度有何影响?(填“偏大”、“偏小”或“无影响”)
①容量瓶中原有少量蒸馏水___,
②定容时俯视观察____,
③把烧碱放在纸上称量____,
④溶解所用的烧杯未洗涤____;
(4)取所配溶液10mL于试管中,加入5mL某浓度的盐酸溶液恰好中和,则所加的盐酸溶液的物质的量浓度是____mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知75mL2mol∕L NaOH溶液的质量为80g,计算溶液中NaOH的质量分数。___
(2)乙酸是实验室常用的一种化学试剂,某乙酸试剂瓶上标签的部分内容如图所示。利用标签提供的信息,回答下列问题:
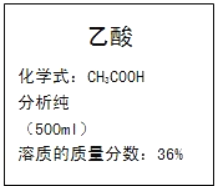
①乙酸的摩尔质量为___。
②若该乙酸溶液的密度为1.02g/cm3,求此乙酸溶液的物质的量浓度。___
③某实验中要用2mol·L-1的乙酸溶液306ml,需要取用上述乙酸溶液多少毫升?___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
A.常温下,0.5L 1.0 mol·L-1Na2SO4溶液中含有的氧原子数为2NA
B.标况下,11.2 L H2O所含电子数为5NA
C.2.4 g镁变为镁离子时失去的电子数为0.1NA
D.常温常压下,32g氧气和臭氧的混合物中所含氧原子总数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米材料一直是人们研究的重要课题,例如纳米级Fe粉表面积大,具有超强的磁性,高效催化性等优良的性质。资料显示:在不同温度下,纳米级Fe粉与水蒸气反应的固体产物不同,温度低于570℃时生成FeO,高于570℃时生成Fe3O4。如下两个装置可在不同温度下进行该反应并验证产物。
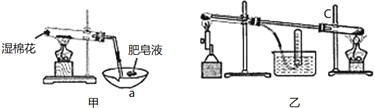
(1)甲装置中仪器a的名称为_____。
(2)装置甲验证气体产物的操作是____。装置C的作用是____。
(3)A同学取出少量乙装置中实验结束后的固体物质于另一试管中,加入少量盐酸,微热,观察到黑色粉末逐渐溶解,溶液呈浅绿色,有少量气泡产生。再向溶液中滴加几滴KSCN溶液,震荡,溶液没有出现红色,推断该条件下生成FeO,B同学却不同意该结论,他的理由是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铅(PbCl2)常用于焊接和制备铅黄等染料。利用从废旧铅蓄电池中得到的铅膏获取氯化铅的流程如图,试回答下列问题:

已知:①铅膏主要由PbSO4、PbO、PbO2和Pb等组成。
②流程图中的“1”表示液体,“s”表示固体。
③硫酸铅、氯化铅微溶于水,但氯化铅能溶于NaCl溶液中,主要发生反应:PbCl2+Cl-==[PbCl3]-。
(1)铅蓄电池的正极材料是________________(填化学式),放电时负极的电极反应式为________。
(2)“浸取反应”是在加热条件下,用盐酸和氯化钠溶液浸取铅膏的过程,主要发生反应的方程式有PbP
PbO2+Pb+4HCl==2PbCl2+2H2O PbO+2HCl==PbCl2+H2O,
PbSO4+2NaCl==PbCl2+Na2SO4 PbCl2+Cl-=[PbCl3]-
除此之外,PbO2还能与HCl反应产生一种黄绿色气体,该反应的化学方程式是________________;该浸取过程中Pb与盐酸反应产生的H2可能会与________ (填气体名称,下同)、________等混合发生爆炸。
(3)PbCl2(溶液显酸性)在氯化钠溶液中的溶解度随温度的升高而增大,适当地升高温度有利于提高铅的浸取率,当温度高于70℃时,浸取率提高不明显,可能的原因是________________________________;为了提高浸取率,还可以采取的措施是________________________________________。
(4)在室温下静置冷却3h后,过滤得到的氯化铅的回收率可达到85%,过滤后得到的滤液进行循环使用可提高铅的利用率。在循环使用之前需加入氯化钙将SO42-进行沉淀转化,若无此步骤,直接循环使用,溶液中SO42-浓度过大,则会导致的结果是________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com