
【题目】下列离子方程式书写正确的是( )
A.制取Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
B.锅炉除水垢时先用纯碱浸泡:CaSO4+CO32-=CaCO3+SO42-
C.泡沫灭火器灭火原理:2Al3++3CO32-+3H2O =2Al(OH)3↓+3CO2↑
D.碳酸钠溶液显碱性:CO32-+2H2OH2CO3+2OH-
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案科目:高中化学 来源: 题型:
【题目】高血脂是一种常见的心血管疾病,治疗高血脂的新药I的合成路线如下:
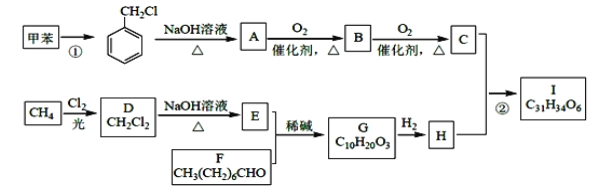
已知:a、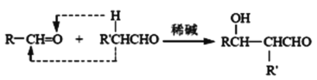
b、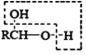
![]() RCHO
RCHO
回答下列问题:
(1)反应①所需试剂、条件分别是____________;A的化学名称为____________。
(2)②的反应类型是______________;A→B 的化学方程式为_________________。
(3)E的结构简式为______________;I 中所含官能团的名称是____________。
(4)化合物W 的相对分子质量比化合物C 大14,且满足下列条件①遇FeCl3 溶液显紫色;②能发生银镜反应,W 的可能结构有____种。其中核磁共振氢谱显示有5 种不同化学环境的氢,峰面积比为2:2:2:1:1,写出符合要求的W 的结构简式________。
(5)设计用甲苯和乙醛为原料制备 ![]() 的合成路线,其他无机试剂任选(合成路线常用的表示方式为A
的合成路线,其他无机试剂任选(合成路线常用的表示方式为A![]() B
B![]() 目标产物。____________
目标产物。____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N、Cu及其相关化合物用途非常广泛。回答下列问题:
(1)基态铜原子的价电子排布式为__________________。
(2)铜与钾处于同周期且最外层电子数相同,铜的熔沸点及硬度均比钾大,其原因是___________________________。
(3)NH3分子的立体构型为_________,中心原子的杂化类型是_________。
(4)N、S、P是组成蛋白质的常见元素。三种元素中第一电离能最大的是_________,电负性最小的是_________。(填元素符号)
(5)已知:Cu2O熔点为1235℃,CuCl熔点为426℃,则可判定Cu2O为_________ (填“离子晶体”或“分子晶体”,下同),CuCl为_________。
(6)氮与铜形成的一种化合物的晶胞结构如图所示。
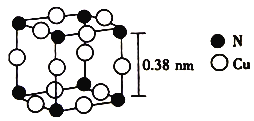
与每个Cu原子紧邻的Cu原子有_________个,阿伏加德罗常数的数值为NA,该晶体的密度为_________ (列出计算式)g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在生产生活中有广泛应用.
![]() 已知:CO可将部分氮的氧化物还原为
已知:CO可将部分氮的氧化物还原为![]() .
.
反应Ⅰ:![]()
反应Ⅱ:![]()
写出CO将![]() 还原为NO的热化学方程式 ______ .
还原为NO的热化学方程式 ______ .
![]() 在密闭容器中充入5molCO和4molNO,发生上述反应I,图1为平衡时NO的体积分数与温度、压强的关系.
在密闭容器中充入5molCO和4molNO,发生上述反应I,图1为平衡时NO的体积分数与温度、压强的关系.
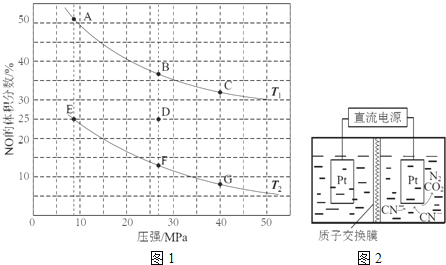
回答下列问题:
![]() 温度:
温度:![]() ______
______ ![]() 填“
填“![]() ”或“
”或“![]() ”
”![]() .
.
![]() 某温度下,在体积为2L的密闭容器中,反应进行10分钟放出热量373kJ,用CO的浓度变化表示的平均反应速率
某温度下,在体积为2L的密闭容器中,反应进行10分钟放出热量373kJ,用CO的浓度变化表示的平均反应速率![]() ______ .
______ .
![]() 某温度下,反应达到平衡状态D点时,容器体积为2L,此时的平衡常数
某温度下,反应达到平衡状态D点时,容器体积为2L,此时的平衡常数![]() ______
______ ![]() 结果精确到
结果精确到![]() ;若在D点对反应容器升温的同时扩大体积使体系压强减小,重新达到的平衡状态可能是图中
;若在D点对反应容器升温的同时扩大体积使体系压强减小,重新达到的平衡状态可能是图中![]() 点中的 ______ 点
点中的 ______ 点
![]() 某温度时,亚硝酸银
某温度时,亚硝酸银![]() 的
的![]() 、
、![]() 的
的![]() ,当向含
,当向含![]() 、
、![]() 混合溶液中加入
混合溶液中加入![]() 溶液至
溶液至![]() 恰好完全沉淀
恰好完全沉淀![]() 即
即![]() 浓度等于
浓度等于![]()
![]() 时,
时,![]() ______ .
______ .
![]() 如图2,在酸性条件下,电解水中
如图2,在酸性条件下,电解水中![]() 可转化为
可转化为![]() 和
和![]() ,请写出阳极的电极反应式 ______ .
,请写出阳极的电极反应式 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室制取无水氯化镁的装置图,下列有关表述正确的是
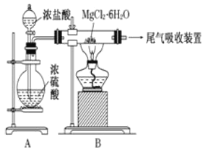
A.装置A中圆底烧瓶中可以换成固体MnO2
B.如果直接加热MgCl26H2O不能得到无水氯化镁,将得到Mg(OH)Cl或MgO
C.尾气吸收可以用浓硫酸作为吸收剂进行吸收
D.金属镁在空气中燃烧,剧烈反应生成氧化镁,如果金属镁燃烧发生火灾,要立即用二氧化碳灭火器进行灭火
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)请用平衡移动原理解释Na2CO3能使溶液中Fe3+转化成氢氧化物沉淀的原因_______。
(2)取浓度相同的NaOH和HCl溶液,以3:2体积比相混合,所得溶液的pH等于12,则该原溶液的浓度(溶液的体积变化忽略不计)为____________。
(3)常温下,将0.1 mol·L-1 的氨水与0.1 mol·L-1的盐酸按一定体积混合。若两溶液混合后,所得溶液中 c(NH4+)=c(Cl-),混合后所得溶液中溶质的电离方程式为_______;水解离子方程式为_______。
(4)已知:Ksp(FeS)=6.5×10-18,Ksp(CuS)=1.3×10-36。向浓度均为0.1 mol·L-1的FeSO4和CuSO4的混合溶液中滴加Na2S溶液,当加入Na2S溶液至出现两种沉淀,则溶液中c(Fe2+) : c(Cu2+) =___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是第二周期VA族元素,形成的N2H4、NH3等多种含氮化合物有着广泛的用途。回答下列问题:
(1)画出氮的核外电子排布图:___________。
(2)①肼(N2H4)又称联氨,常温下是一种可燃性液体,其燃烧热较大且产物对环境无污染,常用作火箭燃料。
已知:N2(g)+O2(g)=2NO(g) ΔH1;
2NO(g)+O2(g)=2NO2(g) ΔH2;
2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) ΔH3;
则反应:N2H4(g)+O2(g)=N2(g)+2H2O ΔH=____(用含ΔH1、ΔH2、ΔH3的代数式表示)。
②肼—空气燃料电池是一种碱性燃料电池,产物无污染,电解质溶液是20%~30%的KOH溶液。肼—空气燃料电池放电时,负极的电极反应式是_____________;正极附近溶液的pH________(填“增大”、“减小”或“不变”)。
(3)某温度下,分别向三个体积为20 L的密闭容器中充入1 mol N2和2.6 mol H2分别保持恒温恒容、恒温恒压和绝热恒容,均发生反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0。三个容器(分别用a、b、c表示)中N2的转化率(α)与反应时间(t)的关系如图所示。
2NH3(g) ΔH<0。三个容器(分别用a、b、c表示)中N2的转化率(α)与反应时间(t)的关系如图所示。
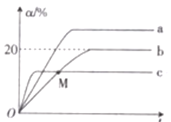
①下列表示恒容时反应已达到平衡状态的是______ (填字母)。
A. 氨气的浓度不再变化 B. v(H2)=3v(N2)
C. ![]() 的值不再变化D. α(N2)=16.7%
的值不再变化D. α(N2)=16.7%
②图中代表反应在绝热恒容容器中进行的曲线是______(填“a”“b”或“c”)。
③b容器中,M点v正_____(填“大于”“小于”或“等于”)v逆。
④曲线a代表的条件下该反应的平衡常数K=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以A(α-蒎烯)为原料可制备香料中间体D和H,合成路线如下:
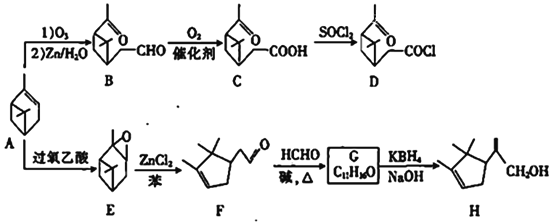
已知:①R1CHO+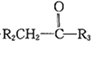
![]()
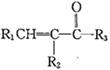 (R1、R2、R3为H或烃基)
(R1、R2、R3为H或烃基)
②一定条件下,R-C≡C-OH可存在。
回答下列问题:
(1)A中的官能团名称是____________,E的分子式为___________
(2)C生成D的反应类型是___________
(3)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。E中有________个手性碳。
(4)G的结构简式为___________
(5)H与足量Br2的CCl4溶液反应的化学方程式为_____________________
(6)W是B的同分异构体,W中没有环状结构,一定条件下,W能水解生成X和Y,X能与NaHCO3反应生成CO2,其核磁共振氢谱只有两组峰,峰面积之比为1:1,Y的核磁共振氢谱有三组峰,蜂面积之比为9:6:1,W的可能结构有_______种.
(7)设计由苯酚制备![]() 的合成路线(无机试剂任选)_________________。
的合成路线(无机试剂任选)_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒触媒(V2O5)是催化氧化所常用的催化剂,为综合利用,科研人员最新研制了一种离子交换法回收废钒的新工艺,回收率达90%以上。已知废钒催化剂中含有V2O5、VOSO4及不溶性残渣。查阅资料可知:VOSO4可溶于水,V2O5难溶于水,NH4VO3难溶于水。该工艺的流程如下图。

(1)水浸时,为了提高废钒的浸出率,除了粉碎,还可以采取的措施:___________________________________,__________________________________(写出2条);
(2)写出反应①的离子方程式_______________________________________________;
(3)该工艺中反应③的沉矾率是回收钒的关键,沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据下图建议最合适的氯化铵系数和温度:氯化铵系数为___________,温度为_____________;

(4)反应②发生后,溶液中的氯元素以Cl-的形式存在,请写出反应②的化学方程式__________________________________________________________________;
(5)查阅资料得知:NH4VO3也叫偏钒酸铵,其相对分子量为117,20℃时,NH4VO3溶解度为0.468g,已知离子交换后溶液中c(VO3-)=0.10mol/L,反应③沉矾时,加入等体积0.10mol/L的NH4Cl溶液,通过列式计算判断此时是否有NH4VO3沉淀析出?(溶液体积变化忽略不计)____________
(6)写出“焙烧反应④”中由NH4VO3制备V2O5的化学方程式__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com