
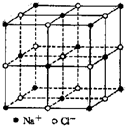
 食盐晶体如图所示.在晶体中,?表示Na+,ο 表示Cl-.已知食盐的密度为ρg/cm3,NaCl摩尔质量Mg/mol,阿伏加德罗常数为N,则在食盐晶体里Na+和Cl-的间距大约是( )
食盐晶体如图所示.在晶体中,?表示Na+,ο 表示Cl-.已知食盐的密度为ρg/cm3,NaCl摩尔质量Mg/mol,阿伏加德罗常数为N,则在食盐晶体里Na+和Cl-的间距大约是( )A、
| |||||
B、
| |||||
C、
| |||||
D、
|
科目:高中化学 来源: 题型:
| A、二者在水中的溶解度不同,碳酸氢钠的溶解度大于碳酸钠的溶解度 |
| B、二者热稳定性不同,碳酸氢钠的热稳定性大于碳酸钠的热稳定性 |
| C、二者都能与盐酸反应放出二氧化碳气体,但碳酸钠生成的气体的速率更快 |
| D、等浓度时,碳酸钠溶液的PH大于碳酸氢钠溶液的PH |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、胶体都是澄清透明的 |
| B、胶体与溶液的本质区别是有丁达尔效应 |
| C、将饱和氯化铁溶液滴入稀氢氧化钠溶液中加热,可得氢氧化铁胶体 |
| D、胶体一定是混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验方案 | 实验操作 | 实验现象 | 结论 |
| 方案1 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成红色 | 白色物质为Na2O |
| 方案2 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液 | 出现白色沉淀 | |
| ③静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 无明显现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向某溶液中加入稀盐酸,产生的气体通入澄清石灰水,石灰水变浑浊.该溶液一定是碳酸盐溶液 |
| B、用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液 |
| C、将某气体通入溴水中,溴水颜色褪去,该气体一定是SO2 |
| D、向某溶液中滴加KSCN 溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验②中发生反应的离子方程式为:Fe2++Cl2=Fe3++2Cl-;Fe3++3SCN-=Fe(SCN)3 |
| B、只做实验①③④,也能达到实验目的 |
| C、通过上述实验可确定该化合物化学式为:(NH4)2Fe(SO4)2?6H2O,是一种浅绿色晶体,商品名为摩尔盐 |
| D、为了检验SO42-,可以将③中的试剂换为HNO3酸化的Ba(NO3)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com