
【题目】磷存在于人体所有细胞中,是维持骨骼和牙齿的必要物质,几乎参与所有生理上的化学反应。回答下列问题:
(1)基态P原子的核外电子排布式为____________________,有___________个未成对电子。
(2)磷的一种同素异形体一一白磷(P4)的立体构型为_______________,其键角为___________,推测其在CS2中的溶解度___________(填“大于”或“小于”)在水中的溶解度。
(3)两种三角锥形气态氢化物膦(PH3)和氨(NH3)的键角分别为93.6°和107°,试分析PH3的键角小于NH3的原因_________________________________。
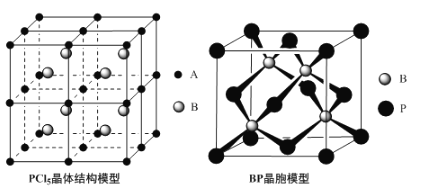
(4)常温下PCl5是一种白色晶体,其立方晶系晶体结构模型如上左图所示,由A、B两种微粒构成。将其加热至148℃熔化,形成一种能导电的熔体。已知A、B两种微粒分别与CCl4、SF6互为等电子体,则A为___________,其中心原子杂化轨道类型为___________,B为___________。
(5)磷化硼(BP)是一种超硬耐磨涂层材料,上图为其立方晶胞,其中的每个原子均测是8电子稳定结构,试判断其熔点___________(填“高于”或“低于”)金刚石熔点。已知其B—P键长均为xcm,则其密度为___________g·cm-3(列出计算式即可)。
【答案】1s22s22p63s23p3 3 正四面体 60° 大于 电负性N强于P,中心原子的电负性越大,成键电子对离中心原子越近,成键电子对之间距离越小,成键电子对之间的斥力增大,键角变大 PCl4+ sp3 PCl6- 低于 ![]() 或
或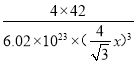
【解析】
(1)根据元素符号,判断元素原子的核外电子数,再根据核外电子排布规律来写;
(2)白磷分子是正四面体结构,四个P原子位于正四面体顶点上,物质溶解性遵循相似相溶原理;
(3)NH3中N原子成3个σ键,有一对未成键的孤对电子,杂化轨道数为4,采取sp3型杂化,孤对电子对成键电子的排斥作用较强,氨气分子空间构型是三角锥形,电负性N强于P,中心原子的电负性越大,成键电子对离中心原子越近,成键电子对之间距离越小;
(4)PCl5是一种白色晶体,在恒容密闭容器中加热可在148℃液化,形成一种能导电的熔体,说明生成自由移动的阴阳离子,一种正四面体形阳离子是PCl4+和一种正六面体形阴离子是PCl6-,即发生反应为:2PCl5=PCl4++PCl6-;
(5)晶胞中:P位于顶点和面心,数目为8×![]() +6×
+6×![]() =4,B位于晶胞内,数目为4,则磷化硼晶体的化学式为BP,由于磷化硼是一种超硬耐磨涂层材料,属于原子晶体,B-P键和C-C键相比,键长大,则熔点低于金刚石;再根据ρ=
=4,B位于晶胞内,数目为4,则磷化硼晶体的化学式为BP,由于磷化硼是一种超硬耐磨涂层材料,属于原子晶体,B-P键和C-C键相比,键长大,则熔点低于金刚石;再根据ρ=![]() 计算密度。
计算密度。
(1)P元素为15号元素,原子核外有15个电子,所以核外电子排布式为:1s22s22p63s23p3,p轨道上是三个自旋方向相同的三个未成对电子;
故答案为:1s22s22p63s23p3;3;
(2)白磷分子是正四面体结构,四个P原子位于正四面体顶点上,所以键角是60°,为非极性分子,相似相容原理可知,易溶于非极性溶剂中,二硫化碳为非极性溶剂,所以白磷在CS2中的溶解度大于在水中的溶解度;
故答案为:正四面体形;60°;大于;
(3)NH3中N原子成3个σ键,有一对未成键的孤对电子,杂化轨道数为4,采取sp3型杂化杂化,孤对电子对成键电子的排斥作用较强,N-H之间的键角小于109°28′,所以氨气分子空间构型是三角锥形,电负性N强于P,中心原子的电负性越大,成键电子对离中心原子越近,成键电子对之间距离越小,成键电子对之间的排斥力增大,键角变大,PH3的键角小于NH3的键角;
故答案为:电负性N强于P,中心原子的电负性越大,成键电子对离中心原子越近,成键电子对之间距离越小,成键电子对之间的排斥力增大,键角变大;
(4)PCl5是一种白色晶体,在恒容密闭容器中加热可在148℃液化,形成一种能导电的熔体,说明生成自由移动的阴阳离子,一种正四面体形阳离子是PCl4+和一种正六面体形阴离子是PCl6-,即发生反应为:2PCl5=PCl4++PCl6-,已知A、B两种微粒分别与CCl4、SF6互为等电子体,则A为:PCl4+,PCl4+中P没有孤电子对。含四个σ键,所以原子杂化方式是sp3,B为:PCl6-;
故答案为:PCl4+;sp3;PCl6-;
(5)磷化硼(BP)与金刚石对比,B、P的原子半径大于C,则磷化硼(BP)中的键长大于金刚石,键能小于金刚石,故其熔点低于金刚石的熔点;根据磷化硼晶胞模型可知,1个晶胞中含有4个硼原子,P=8×![]() +6×
+6×![]() =4,则1mol晶胞中含有4molBP,晶胞的棱长=2
=4,则1mol晶胞中含有4molBP,晶胞的棱长=2![]() xsin54°44’,则体积为=(2
xsin54°44’,则体积为=(2![]() xsin54°44’)3,ρ=
xsin54°44’)3,ρ=![]() =
=![]() 或
或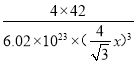 ;
;
故答案是:低于;![]() 或
或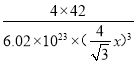 。
。


科目:高中化学 来源: 题型:
【题目】水质检验中,测定水的硬度时,用到氨-氯化氨![]() 缓冲溶液,控制溶液在
缓冲溶液,控制溶液在![]() 左右.则关于该缓冲溶液的说法不正确的是
左右.则关于该缓冲溶液的说法不正确的是
A.将缓冲溶液加水稀释时,pH一定会减小
B.将缓冲溶液升温,pH一定没有变化
C.在缓冲溶液中,水的电离受到抑制
D.在缓冲溶液中,一定有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D均为中学化学中常见的物质,它们之间转化关系如图(部分产物已略去):
A![]() B
B![]() C
C
试回答:
(1)若D是具有氧化性的单质,则属于主族的金属A为___________(填元素符号)
(2)若D是金属,C溶液在储存时应加入少量金属D,其理由是(用必要的文字和离子方程式表示)______
(3)若A、B、C为含同一种金属元素的无机化合物,且三种物质中有一种是白色不溶物。在溶液中A和C反应生成B。请写出B转化为C的所有可能的离子力程式_________、_________
(4)某一离子反应体系有反应物和产物共以下六种:MnO4-、H+、O2、H2O、H2O2、Mn2+。
①写出该氧化还原反应的离子方程式_______
②溶液随着酸性的增强氧化性不断增强,应选择_________(选填“稀硫酸”或“浓盐酸”)进行KMnO4溶液的酸化。
③如反应转移了0.6mo1电子,则产生的气体在标准状况下体积为__________
(5)一份溶液中可能含有K+、Al3+、Mg2+、Fe2+、 H+、NH4+、Cl-、HCO3-、ClO-、AlO2-等离子中的若干种。为了确定溶液的组成,进行了如下操作:
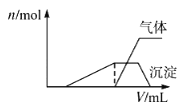
往该溶液中逐滴加入NaOH溶液并适当加热,产生沉淀和气体的物质的量(n)与加入NaOH溶液的体积关系如图所示;则该溶液中一定存在的离子是_______,一定不存在的离子是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示可设计成多种用途的电化学装置,下列说法错误的是
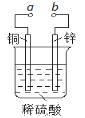
A.a与电源正极相连时,铜做阳极
B.a和b用导线连接时,SO42-向铜片移动
C.a和b用导线连接时,铜片上发生的反应为:2H++2e→H2↑
D.a与电源正极相连可以保护锌片
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有K+、NH4+、Ba2+、SO42-、I-、Cl-、NO3-中的几种,将此溶液分成两等份。进行如下实验:(AgCl式量为143.5,AgI式量为235)
①在一份溶液中加入足量NaOH,加热,可收集到标准状态下的气体1.12L;
②在另一份溶液中加入足量Ba(NO3)2溶液,有白色沉淀产生,过滤得到沉淀2.33g;
③在②的滤液中加入足量AgNO3溶液,又有4.7g沉淀产生。
有关该溶液中离子种类(不考虑H+和OH-)的判断正确的是
A.溶液中至少有2种阳离子
B.只能确定溶液中NH4+、SO42-是否存在
C.溶液中最多有4种阴离子
D.溶液中不可能同时存在K+和NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】链状有机物A是一种食用型香精,在一定条件下有如下变化:
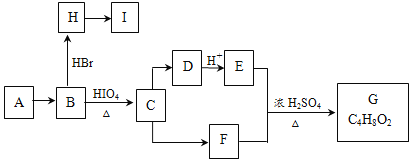
已知:(1)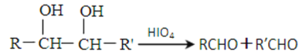
(2)A和G互为同分异构体,A不能使Br2的CCl4溶液褪色。B和F中所含官能团的类型相同。
完成下列填空:
(1)F的分子式为________________;C→D的反应类型是__________________________。
(2)A的结构简式为________________________________。
(3)若C中混有少量的E,请写出相应的除杂试剂和分离方法:________________。
(4)I中所有碳原子均在一条直线上,H转化为I的化学方程式为:______________________。
(5)X是A的一种同分异构体,1mol X在HIO4加热条件下完全反应,可以生成1mol无支链有机物,则X的结构简式为_________________。
(6)设计有1-丁烯为原料,合成H的合成路线。(合成路线常用的表示方式为:甲![]() 乙……
乙……![]() 目标产物)______________________________________
目标产物)______________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
B.用FeCl3溶液腐蚀印刷铜电路板:Fe3++Cu=Fe2++Cu2+
C.用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O
D.实验室用浓盐酸与MnO2反应制Cl2:MnO2+2H++2Cl-![]() Mn2++Cl2↑+H2O
Mn2++Cl2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有以下几种有机物:
①![]() ②
②![]() ③
③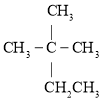 ④
④![]() ⑤
⑤![]()
⑥![]() ⑦
⑦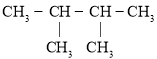 ⑧
⑧![]() ⑨
⑨![]()
请利用上述给出的物质按要求回答下列问题:
(1)③的系统命名是________。
(2)用“>”表示①③④⑧熔沸点高低顺序:________(填序号)。
(3)与③互为同系物的是________(填序号)。
(4)⑨的一氯代物同分异构体数目有________种。
(5)在120℃,![]() 条件下,某种气态烃与足量的
条件下,某种气态烃与足量的![]() 完全反应后,测得反应前后气体的体积没有发生改变,则该烃是________(填序号)。
完全反应后,测得反应前后气体的体积没有发生改变,则该烃是________(填序号)。
(6)写出⑥在铁作催化剂的条件下与液溴发生取代反应的化学方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备溴苯可用下图所示装置。请回答下列问题:
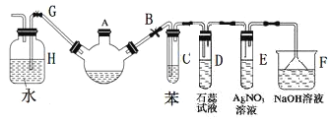
(1)关闭G夹,打开B夹,从装有少量苯的三颈烧瓶的A口加少量溴,再加入少量铁屑,塞住A口,三颈烧瓶中发生的主要反应的化学方程式为___________________。
(2)试管C中苯的作用是_________________。试管D中出现的现象是______________。试管E中出现的现象是_______________。
(3)待三颈烧瓶中的反应进行到仍有气泡冒出时打开G夹,关闭B夹,可以看到的现象是__________________。
(4)三颈烧瓶中的溴苯经过下列步骤分离提纯:
①向三颈烧瓶中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤。NaOH溶液洗涤的作用是除去多余的溴;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是干燥产品。
④经过上述分离操作后,要进一步提纯,下列操作中必须的是_________(填入正确选项前的字母)。
A 重结晶 B 过滤 C 蒸馏 D 萃取
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com