
下列有关化学用语的描述不正确的是( )
A. MgF2的电子式: 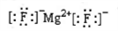
B. 中子数为15的硅原子: 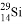
C. 乙烯的结构简式:CH2CH2
D. NH3•H20 的电离方程式: NH3•H20  NH4+ + 0H-
NH4+ + 0H-
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源:2016-2017学年河北省石家庄市高一上学期期末考试化学试卷(解析版) 题型:填空题
现有下列八种物质:①铝②蔗糖③SiO2④H2SO4⑤NaOH⑥FeSO4溶液⑦Ba(OH)2⑧氢氧化铁胶体
(1)上述物质属于电解质的有_________。(填序号)
(2)向⑥中加入少量⑤的溶液,观察的现象为___________。
(3)上述物质中有两种物质在水溶液中反应的离子方程式为H++OH-=H2O,则该反应的化学方程式为_____。
(4)若在⑧中缓慢加入⑤,产生的现象是___________。
(5)③和⑤是玻璃的主要成分之一,③与⑥溶液反应的化学方程式为________,工艺师常用______(填物质名称)来雕刻玻璃。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省宜昌市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列推断正确的是( )
A. 铝粉在氧气中燃烧生成Al2O3,故铁丝在氧气中燃烧生成Fe2O3
B. 铁能从硫酸铜溶液中置换出铜,故钠也能从硫酸铜溶液中置换出铜
C. 活泼金属钠保存在煤油中,故活泼金属铝也保存在煤油中
D. 钠与氧气、水等反应时钠均作还原剂,故金属单质参与反应时金属均作还原剂
查看答案和解析>>
科目:高中化学 来源:2017届福建省漳州市八校高三上学期期末联考化学试卷(解析版) 题型:选择题
将一定量的镁和铜组成的混合物加入到稀硝酸中,金属完全溶解(假设反应中还原产物只有NO).向反应后的溶液中加入3mol/L NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加 5.1g.下列叙述不正确的是( )
A. 当金属全部溶解时,参加反应的硝酸的物质的量一定是0.4mol
B. 参加反应的金属的总质量 3.6g<m<9.6 g
C. 当生成的沉淀量达到最大时,消耗NaOH溶液的体积V=100mL
D. 当金属全部溶解时收集到NO气体的体积在标况下为 2.24L
查看答案和解析>>
科目:高中化学 来源:2017届福建省漳州市八校高三上学期期末联考化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. 0.1mol•L﹣1CH3COONa溶液:H+、Al3+、Cl﹣、NO3﹣
B. 含有NaNO3的溶液:H+、Fe2+、SO42﹣、Cl﹣
C. 能使甲基橙变红的溶液:K+、Na+、NO3﹣、Cl﹣
D. 由水电离产生的c(H+)=10﹣12 mol•L﹣1的溶液:NH4+、SO42﹣、HCO3﹣、Cl﹣
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高二下学期开学考试化学试卷(解析版) 题型:填空题
苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是:C8H10(g)?C8H8(g)+H2(g)△H=120kJ·mol-1某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内气体物质的量,得到数据如下表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(C8H10)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
(1)当反应进行到20min时,该段时间内H2的平均反应速率是_____________。
(2)该温度下,该反应的化学平衡常数是_______________________。
(3)若保持其他条件不变,用0.40 mol H2(g)和0.40mol C8H8(g)合成C8H10(g),当有30kJ热量放出时,该反应中H2的转化率是__________。此时,该合成反应是否达到了平衡状态?_______(填“是”或“否”)。
(4)工业上以高温水蒸气作为反应体系的稀释剂(不参与反应),C8H10(g)的平衡转化率与水蒸气的用量、体系的温度、压强的关系如图Ⅰ、图Ⅱ所示。
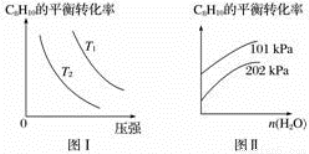
①由图Ⅰ可知,T1________T2(填“大于”、“小于”或“等于”)。
②由图Ⅱ可知,当其他条件不变时,水蒸气的用量越大,C8H10的平衡转化率将________(填“越大”、“越小”或“不变”),原因是______________________________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高二下学期开学考试化学试卷(解析版) 题型:选择题
用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.1molCu2(OH)2CO3后恰好恢复到电解前的浓度和pH(不考虑CO2的溶解)。则电解过程中共转移电子的物质的量为( )
A. 0.4mol B. 0.5mol C. 0.6mol D. 0.8mol
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省宜昌市高二上学期期末考试化学试卷(解析版) 题型:选择题
在50 m L 0.1mol/L Na2S 溶液中逐滴加入50 mL 0.1mol/L KHSO4溶液,所得溶液中粒子浓度关系正确的是
A. c(SO42-)= c(HS-)= c(K+)>c(OH-)= c(H+)
B. c(Na+)> c(K+)> c(S2-)> c(H+)> c(OH-)
C. c(Na+)= c(S2-)+ c(HS-)+ c(H2S)+ c(SO42-)
D. c(K+)+ c(Na+)+ c(H+)= c(SO42-)+ c(S2-)+ c(HS-)+ c(OH-)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省天水市高二下学期开学考试(寒假作业检测)化学试卷(解析版) 题型:填空题
已知水在25℃和95℃时,其电离平衡曲线如图所示.
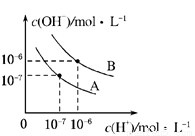
(1)95℃时水的电离平衡曲线应为______(填“A”或“B”),理由是______.
(2)曲线A所对应的温度下,pH=2的HCl溶液和pH=12的某BOH溶液中,若水的电离程度分别用α1、α2表示,则α1______α2(填“大于”、“小于”、“等于”或“无法确定”,下同),若将二者等体积混合,则混合溶液的pH______7.
(3)在曲线B所对应的温度下,将0.02mol•L﹣1的Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合,所得混合液的pH=______.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com