
| A. | 电解饱和食盐水可冶炼金属钠 | |
| B. | 氧化钠可用于呼吸面具 | |
| C. | 铝热反应中的铝热剂是混合物 | |
| D. | 凡含有添加剂的食物对人体健康均有害,不宜食用 |
分析 A、电解饱和食盐水得到氢氧化钠、氢气和氯气;
B、氧化钠可以和水以及二氧化碳之间反应,但是不会得到氧气;
C、铝热剂是铝热反应的反应物,为金属铝和金属氧化物的混合物;
D、适量的添加剂不会对身体有害,并且可以起到正面的作用.
解答 A、电解饱和食盐水得到氢氧化钠、氢气和氯气,电解熔融的氯化钠,可以得到金属钠,故A错误;
B、氧化钠可以和水以及二氧化碳之间反应,但是不会得到氧气,常用过氧化钠做氧气的来源,故B错误;
C、铝热剂是铝热反应的反应物,为金属铝和金属氧化物的混合物,故C正确;
D、适量的添加剂不会对身体有害,并且可以起到正面的作用,如食品防腐剂的适量添加,可以减慢食物的腐败,故D错误.
故选C.
点评 本题涉及物质的性质以及应用方面的知识,注意知识的迁移和应用在解题中的应用是解题的关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | CuSO4发生还原反应,白磷只作还原剂 | |
| B. | 氧化产物和还原产物的物质的量之比为6:5 | |
| C. | P4是一种正四面体型分子,每个P4分子中含有6个P-P非极性键 | |
| D. | 该反应中被硫酸铜氧化的白磷P4有3 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液:Cu2+、K+、Cl-、CO${\;}_{3}^{2-}$ | |
| B. | 使酚酞显红色的溶液:Mg2+、Fe2+、Cl-、SO${\;}_{4}^{2-}$ | |
| C. | 加Fe粉能产生H2的溶液:Ba2+、Na+、Cl-、SO${\;}_{4}^{2-}$ | |
| D. | 加盐酸能产生气体的溶液:Na+、K+、NO${\;}_{3}^{-}$、HCO${\;}_{3}^{-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1LH2SO4溶液中含98gH2SO4 | B. | 0.5L含49gH2SO4的溶液 | ||
| C. | 98gH2SO4溶于水配成2 L溶液 | D. | 1L含196gH2SO4的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6L | B. | 11.2L | C. | 2.24L | D. | 4.48L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某燃料电池用熔融碳酸盐作电解质,两极分别通入CO和O2,则通入CO的一极为负极,电极反应式为CO-2e-+CO32-=2CO2 | |
| B. | Zn粒与稀硫酸反应制氢气时,为加快反应速率,可在反应过程中滴加几滴CuSO4溶液 | |
| C. | 根据自发氧化还原反应Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O设计原电池,可在常温下用铜和铁作电极,使用浓硝酸作电解质溶液 | |
| D. | 原电池中电子从负极出发,经外电路流向正极,再从正极经电解液回到负极构成闭合回路 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用前要无需检验容量瓶是否漏液 | |
| B. | 用蒸馏水洗涤后必须要将容量瓶烘干 | |
| C. | 为了便于操作,浓溶液稀释或固体溶解可直接在容量瓶中进行 | |
| D. | 为了使所配溶液浓度均匀,定容结束后,要摇匀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
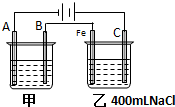 如图为相互串联的甲、乙两电解池试回答:
如图为相互串联的甲、乙两电解池试回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com