
| c(PCl3)?c(Cl2) |
| c(PCl5) |
| c(PCl3)?c(Cl2) |
| c(PCl5) |
| c(PCl3)?c(Cl2) |
| c(PCl5) |
| 0.15��0.15 |
| 0.05 |
| 1 |
| 0.45 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| c(PCl3)?c(Cl2) |
| c(PCl5) |
| c(PCl3)?c(Cl2) |
| c(PCl5) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
PCl5��g��![]() PCl3(g) + Cl2(g)
PCl3(g) + Cl2(g)
(1) д����Ӧ��ƽ�ⳣ������ʽ��
(2) ��֪ij�¶��£����ݻ�Ϊ10.0L���ܱ������г���2.00mol PCl5���ﵽƽ����������PCl3��Ũ��Ϊ0.150mol/L��������¶��µ�ƽ�ⳣ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ��ӱ�ʡ��һ�и߶�9���¿���ѧ�Ծ����������� ���ͣ�������
��6�֣�PCl5���ȷֽⷴӦ���£�PCl5(g)  PCl3(g) + Cl2(g)��
PCl3(g) + Cl2(g)��
��1��д����Ӧ��ƽ�ⳣ������ʽ��
��2����֪ij�¶��£����ݻ�Ϊ10.0L���ܱ������г���2.00mol PCl5���ﵽƽ����������PCl3��Ũ��Ϊ0.150mol/L������¶��µ�ƽ�ⳣ����
��3������ͬ����������ʼ����5.00mol PCl5����ƽ��� PCl5�ķֽ����Ƕ��٣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013��ӱ�ʡ�߶�9���¿���ѧ�Ծ��������棩 ���ͣ�������
��6�֣�PCl5���ȷֽⷴӦ���£�PCl5(g) 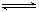 PCl3(g)
+ Cl2(g)��
PCl3(g)
+ Cl2(g)��
��1��д����Ӧ��ƽ�ⳣ������ʽ��
��2����֪ij�¶��£����ݻ�Ϊ10.0L���ܱ������г���2.00mol PCl5���ﵽƽ����������PCl3��Ũ��Ϊ0.150mol/L������¶��µ�ƽ�ⳣ����
��3������ͬ����������ʼ����5.00mol PCl5����ƽ��� PCl5�ķֽ����Ƕ��٣�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com