
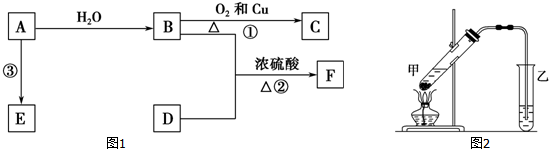
 ,B的官能团名称为羟基.
,B的官能团名称为羟基.分析 A的产量通常用来衡量一个国家石油化工水平,则A是CH2=CH2,乙烯和水发生加成反应生成B为CH3CH2OH,乙醇发生氧化反应生成C为CH3CHO,F是一种有香味的物质,D是生活中常见的有机物,F中碳原子数是D的两倍,可推知D为CH3COOH,乙酸与乙醇发生酯化反应生成F为CH3COOCH2CH3,乙烯发生加聚反应生成高分子化合物E为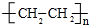 ,据此解答.
,据此解答.
解答 解:A的产量通常用来衡量一个国家石油化工水平,则A是CH2=CH2,乙烯和水发生加成反应生成B为CH3CH2OH,乙醇发生氧化反应生成C为CH3CHO,F是一种有香味的物质,D是生活中常见的有机物,F中碳原子数是D的两倍,可推知D为CH3COOH,乙酸与乙醇发生酯化反应生成F为CH3COOCH2CH3,乙烯发生加聚反应生成高分子化合物E为 .
.
(1)A是CH2=CH2,结构式为 ,B为CH3CH2OH,决定性质的重要官能团的名称为:羟基,
,B为CH3CH2OH,决定性质的重要官能团的名称为:羟基,
故答案为: ;羟基;
;羟基;
(2)反应①的化学方程式为:2CH3CH2OH+O2 $→_{△}^{Cu}$2CH3CHO+2H2O,属于氧化反应;
反应②的化学方程式为:CH3CH2OH+CH3COOH$→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,属于酯化反应或取代反应,
故答案为:2CH3CH2OH+O2 $→_{△}^{Cu}$2CH3CHO+2H2O,氧化反应;CH3CH2OH+CH3COOH$→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,酯化反应或取代反应;
(3)鉴别乙醇与乙酸的方法为:取某一待测液于试管中,滴加少量石蕊溶液,若溶液变红,则所取待测液为乙酸,余下一种为乙醇,
故答案为:取某一待测液于试管中,滴加少量石蕊溶液,若溶液变红,则所取待测液为乙酸,余下一种为乙醇;
(4)图中导气管的出口伸入到了液面以下,会导致倒吸,
故答案为:导气管的出口伸入到了液面以下.
点评 本题考查无机物推断、乙酸乙酯制备,涉及烯烃、醇、醛、羧酸的性质与转化,比较基础,侧重对基础知识的巩固.


科目:高中化学 来源: 题型:解答题
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达平衡所需时间/min | ||
| CO | H2O | CO | H2 | |||
| 1 | 650 | 2 | 4 | 0.5 | 1.5 | 5 |
| 2 | 900 | 1 | 2 | 0.5 | 0.5 | - |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH2+H2→CH3-CH3 | B. | CH2=CH2+3O2→2CO2+2H2O | ||
| C. | CH2=CH2+Br2→CH2Br-CH2Br | D. | CH2=CH2+H2O$\frac{\underline{\;催化剂\;}}{\;}$CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯和浓溴水混合加入铁作催化剂制溴苯 | |
| B. | 将苯和浓硝酸混合共热制硝基苯 | |
| C. | 可用分液漏斗分离硝基苯和水 | |
| D. | 乙烯通入溴的四氯化碳溶液中获得1,1-二溴乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1H、D、T互为同位素 | B. | 金刚石、石墨、C60互为同分异构体 | ||
| C. | SO2和SO3互为同分异构体 | D. | 正丁烷和异丁烷互为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务.
能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务.查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 用如图 I装置制乙烯 | |
| B. | 用如图Ⅱ装置分离溴乙烷 和水 | |
| C. | 用如图Ⅲ装置制硝基苯 | |
| D. | 分离苯和苯酚混合物应按顺序进行以下操作,加入NaOH溶液后振荡,用分液漏斗分离,取下层液体通入CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com