
【题目】CO的催化氧化在消除环境污染、净化空气等方面有重要价值。最新研究发现:常温下CO在Au/BN表面很难被O2氧化,但在H2O的参与下反应很容易发生,转化示意图如图:

下列说法正确的是( )
A.CO2和H2O均只含极性共价键,且为极性分子
B.过程①有氢键形成
C.催化剂可以改变反应的路径,但不会改变反应速率和限度
D.在H2O和Au/BN的共同作用下,CO易被O2氧化
科目:高中化学 来源: 题型:
【题目】已知溶液中,还原性HSO3>I-,氧化性IO3->I2。在含有3molNaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系如图所示,则下列说法中错误的是

A. a点时NaHSO3剩余
B. b点时还原产物为I-
C. b点到c点,KIO3与NaHSO3反应生成I2
D. 加入的KIO3为0.4mol或1.12mol时,反应后溶液中I-均为0.4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关短周期主族元素A、B、C、D、E、F的信息如下:
有关信息 | |
A | 其中一种核素的中子数为0 |
B | 最高价氧化物对应的水化物按1:1完全电离出电子数相等的阴、阳离子 |
C | 在地壳中的含量为第三位 |
D | 其单质在O2中燃烧,发出明亮的蓝紫色火焰 |
E | 是形成化合物种类最多的元素 |
F | 其单质常用做保护气体 |
(1)C元素是________(填元素名称),D在元素周期表中的位置是________。
(2)工业上得到C的单质常采用惰性电极电解熔融______(填化学式)的方法,C的单质可以和B的最高价氧化物的水化物发生反应,写出该反应的离子方程式:______。C形成某种化合物LiCA4既是金属储氢材料又是有机合成中的常用试剂,遇水能释放出A2,那么LiCA4中A元素的化合价为_________。
(3)在一定条件下,A与F可形成一种易溶于水的液体F2A4,其电子式为________;该物质可由NaClO与FA3反应制得,写出反应的化学方程式:_______,每生成1mol F2A4转移电子数为________。
(4)写出一个能证明E和F非金属性强弱的化学方程式________。
(5)化合物W由A、D、E、F四种元素组成。向W溶液中滴入FeCl3溶液,溶液变血红色;另取一份W溶液加入强碱溶液并加热,产生能使湿润的红色石蕊试纸变蓝的气体,W的化学式为________。
(6)F的简单氢化物的沸点比它的同族相邻周期元素氢化物沸点高,理由是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL![]() 的HR溶液中逐滴滴入
的HR溶液中逐滴滴入![]() 的
的![]() 溶液,所得溶液pH及导电能力变化如图
溶液,所得溶液pH及导电能力变化如图![]() 下列分析不正确的是
下列分析不正确的是![]()
![]()

A. ![]() 点导电能力增强,说明HR为弱酸
点导电能力增强,说明HR为弱酸
B. b点溶液![]() ,此时酸碱恰好中和
,此时酸碱恰好中和
C. c点溶液存在![]() 、
、![]()
D. b、c两点水的电离程度:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大,a、b、c、d、e、f是由这些元素组成的化合物,d是淡黄色粉末,m为元素Y的单质,通常为无色无味的气体。上述物质的转化关系如图所示。下列说法错误的是( )

A.简单离子半径:Z<Y
B.第一电离能:Y<X
C.m中存在离子键和极性键
D.W2Y2中含有非极性键,为极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在钯基催化剂表面上,甲醇制氢的反应历程如图所示,其中吸附在钯催化剂表面上的物种用*标注。

(1)![]() 的△H=_____________kJ·mol-1;该历程中最大能垒(活化能)E正=____________kJ·mol-1,写出该步骤的化学方程式_________________。
的△H=_____________kJ·mol-1;该历程中最大能垒(活化能)E正=____________kJ·mol-1,写出该步骤的化学方程式_________________。
(2)在一定温度下,CO和H2混合气体发生反应:![]() ,反应速率υ=υ正-υ逆=k正c(CO)·c2(H2)-k逆c(CH3OH),k正、k逆分别为正、逆反应速率常数。达到平衡后,若加入高效催化剂,
,反应速率υ=υ正-υ逆=k正c(CO)·c2(H2)-k逆c(CH3OH),k正、k逆分别为正、逆反应速率常数。达到平衡后,若加入高效催化剂,![]() 将___________(填“增大”、“减小”或“不变”);若升高温度,
将___________(填“增大”、“减小”或“不变”);若升高温度,![]() 将____________(填“增大”、“减小”或“不变”)。
将____________(填“增大”、“减小”或“不变”)。
(3)353K时,在刚性容器中充入CH3OH(g),发生反应:![]() 。体系的总压强p随时间t的变化如表所示:
。体系的总压强p随时间t的变化如表所示:
t/min | 0 | 5 | 10 | 15 | 20 | ∞ |
p/kPa | 101.2 | 107.4 | 112.6 | 116.4 | 118.6 | 121.2 |
①若升高反应温度至373K,则CH3OH(g)分解后体系压强p∞(373K)___________121.2kPa(填“大于”、“等于”或“小于”),原因是________________________。
②353K时,该反应的平衡常数KP=__________(kPa)2(KP为以分压表示的平衡常数,计算结果保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有机物A、B、C、D、E、F、G有如下转化关系,其中C的产量可用来衡量一个国家的石油化工发展水平,G的分子式为![]() ,试回答下列有关问题。
,试回答下列有关问题。
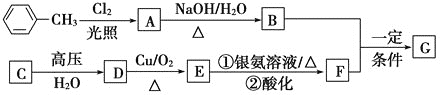
(1)G的结构简式为_________。
(2)指出下列反应的反应类型:A转化为B:________,C转化为D:__________。
(3)写出下列反应的化学方程式
D生成E的化学方程式:___________________。
A生成B的化学方程式:__________________。
(4)符合下列条件的G的同分异构体有________种。
a.苯环上有3个取代基,且有两个取代基相同;
b.能够与新制的银氨溶液反应产生光亮的银镜。
其中共有四种不同化学环境氢原子的同分异构体的结构简式为________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下:(NA为阿伏加德罗常数的值),请用化学用语回答下列
元素 | 相关信息 |
A | 基态原子的价电子排布式为nsnnpn |
B | 元素原子的核外p电子数比s电子数少1个 |
C | 最外层电子数是电子层数的3倍 |
D | 简单离子是第三周期元素中离子半径最小的 |
E | 价电子层中的未成对电子数为4 |
(1)写出D元素在周期表的位置___,基态E2+价电子的排布图为___,B元素能量最高的电子其轨道呈__形。
(2)A与C形成的最高价化合物,中心原子轨道杂化类型为__。
(3)A、B、C三种基态原子的第一电离能由大到小的顺序为___,B、C、D简单离子的半径由大到小的顺序为___。
(4)写出C的核外有18个电子的氢化物的电子式___。
(5)E可用做某些反应的催化剂,CO易导致E失去催化活性:E+5CO=E(CO)5,E(CO)5熔点为-20℃,沸点为103℃,易溶于乙醚,其晶体类型为___。
(6)已知沸点:B2H4>A2H6,主要原因为________。
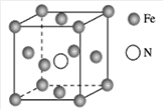
(7)铁的多种化合物均为磁性材料,氮化铁是其中一种,某氮化铁的晶胞结构如图所示,则氮化铁的化学式为___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是(阿伏伽德罗常数为NA)( )
A.氯气跟水反应的离子方程式:Cl2+H2O=2H++Cl-+ClO-
B.15.6克Na2O2中所含的离子总数为0.6NA
C.11克D218O中含有的中子数为6NA
D.![]() 和
和![]() 质子数相同,但属于不同种核素
质子数相同,但属于不同种核素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com