
【题目】有关短周期主族元素A、B、C、D、E、F的信息如下:
有关信息 | |
A | 其中一种核素的中子数为0 |
B | 最高价氧化物对应的水化物按1:1完全电离出电子数相等的阴、阳离子 |
C | 在地壳中的含量为第三位 |
D | 其单质在O2中燃烧,发出明亮的蓝紫色火焰 |
E | 是形成化合物种类最多的元素 |
F | 其单质常用做保护气体 |
(1)C元素是________(填元素名称),D在元素周期表中的位置是________。
(2)工业上得到C的单质常采用惰性电极电解熔融______(填化学式)的方法,C的单质可以和B的最高价氧化物的水化物发生反应,写出该反应的离子方程式:______。C形成某种化合物LiCA4既是金属储氢材料又是有机合成中的常用试剂,遇水能释放出A2,那么LiCA4中A元素的化合价为_________。
(3)在一定条件下,A与F可形成一种易溶于水的液体F2A4,其电子式为________;该物质可由NaClO与FA3反应制得,写出反应的化学方程式:_______,每生成1mol F2A4转移电子数为________。
(4)写出一个能证明E和F非金属性强弱的化学方程式________。
(5)化合物W由A、D、E、F四种元素组成。向W溶液中滴入FeCl3溶液,溶液变血红色;另取一份W溶液加入强碱溶液并加热,产生能使湿润的红色石蕊试纸变蓝的气体,W的化学式为________。
(6)F的简单氢化物的沸点比它的同族相邻周期元素氢化物沸点高,理由是__________。
【答案】铝 第三周期VIA族 Al2O3 2Al+2OH- +2H2O=2AlO2- +3H2↑ -1 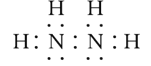 NaClO+2NH3=NaCl+N2H4+H2O 2NA NaHCO3+HNO3=NaNO3+H2O+CO2 ↑(或Na2CO3+2HNO3=2NaNO3+H2O+CO2↑) NH4SCN NH3分子间存在氢键
NaClO+2NH3=NaCl+N2H4+H2O 2NA NaHCO3+HNO3=NaNO3+H2O+CO2 ↑(或Na2CO3+2HNO3=2NaNO3+H2O+CO2↑) NH4SCN NH3分子间存在氢键
【解析】
短周期主族元素A、B、C、D、E、F,A的其中一种核素的中子数为0,是H;B的最高价氧化物对应的水化物按1:1完全电离出电子数相等的阴、阳离子,是Na;C在地壳中的含量为第三位,是Al;D单质在O2中燃烧,发出明亮的蓝紫色火焰,是S;E是形成化合物种类最多的元素,是C;F单质常用做保护气体,是N;A、B、C、D、E、F分别是H、Na、Al、S、C、N,据此分析。
(1)根据分析可知,C元素铝,D元素是S ,硫有三层电子,最外层电子数为6,D在元素周期表中的位置是第三周期第VIA族;
(2)活泼金属一般采用电解法冶炼,工业上得到C的单质常采用惰性电极电解熔融Al2O3的方法,C的单质可以和B的最高价氧化物的水化物发生反应的离子方程式:2Al+2OH- +2H2O=2AlO2- +3H2↑,LiCA4即LiAlH4,Li为+1价,Al为+3价,H为-1价,H元素的化合价为-1价;
(3)在一定条件下,A与F可形成一种易溶于水的液体F2A4,即N2H4,其电子式为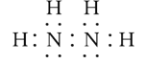 ;该物质可由NaClO与NH3反应制得,根据元素守恒,写出反应的化学方程式:NaClO+2NH3=NaCl+N2H4+H2O,N元素的化合价从-3升高到-2价,Cl元素的化合价从+1降低到-1价,每生成1mol N2H4,转移电子的物质的量为2mol,转移的电子数目为2NA;
;该物质可由NaClO与NH3反应制得,根据元素守恒,写出反应的化学方程式:NaClO+2NH3=NaCl+N2H4+H2O,N元素的化合价从-3升高到-2价,Cl元素的化合价从+1降低到-1价,每生成1mol N2H4,转移电子的物质的量为2mol,转移的电子数目为2NA;
(4)C和N位于同一周期,同周期元素的非金属性逐渐增强,N的非金属性强于C,可以用最高价氧化物对应的水化物的酸性强弱来验证,由硝酸制取碳酸,可以设计成为:NaHCO3+HNO3=NaNO3+H2O+CO2 ↑(或Na2CO3+2HNO3=2NaNO3+H2O+CO2↑);
(5)化合物W由A、D、E、F四种元素组成,即H、S、C、N,向W溶液中滴入FeCl3溶液,溶液变血红色,说明W中含有硫氰根离子;另取一份W溶液加入强碱溶液并加热,产生能使湿润的红色石蕊试纸变蓝的气体,说明产生了氨气,铵根离子遇到强碱加热会产生氨气,则W中含有铵根离子,W的化学式为NH4SCN;
(6)N的电负性较强,它的氢化物是氨气,氨分子间易形成氢键,故氨气沸点比它的同族相邻周期元素氢化物沸点高;


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
【题目】芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有关汉黄芩素的叙述不正确的是
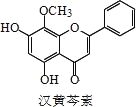
A.汉黄芩素的分子式为 C16H12O5
B.该物质遇 FeCl3 溶液显色
C.1 mol 该物质与溴水反应,最多消耗 2mol Br2
D.与足量 H2 发生加成反应后,该分子中官能团的种类减少 3 种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应:
A.CaCO3![]() CaO+CO2↑
CaO+CO2↑
B.Zn+H2SO4=ZnSO4+H2↑
C.C+CO2![]() 2CO
2CO
D.2KOH+H2SO4=K2SO4+2H2O
(1)上述四个反应中属于氧化还原反应且反应过程中能量变化符合如图的是_______(填反应序号)。
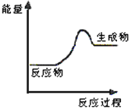
(2)在常温下,上述四个反应中可用于设计原电池的是__________(填反应序号),根据该原电池回答下列问题:
①负极材料是______,负极发生______(填“氧化”或“还原”)反应;正极反应式为_____。
②当导线中有1 mol电子通过时,理论上发生的变化是 _______ (填序号)。
a.溶液增重32.5 g b.溶液增重31.5 g
c.析出1g H2 d.析出11.2LH2
(3) 对于反应B,将足量且等量的形状相同的锌块分别加入到等浓度等体积的两份稀硫酸X、Y中,同时向X中加入少量饱和CuSO4溶液,发生反应生成氢气的体积(V)与时间(t)的关系如图所示。
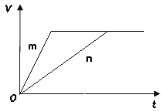
① m曲线表示锌与稀硫酸_________(填“X”或“Y”)反应。
② 锌分别与稀硫酸X、Y反应时,反应速率不同的原因是________(填序号)。
a. CuSO4作催化剂
b.加入硫酸铜溶液增大了c(![]() )
)
c.Zn首先与Cu2+反应,生成的Cu与Zn、稀硫酸构成原电池
d.加入硫酸铜溶液增大了溶液体积
(4)理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应2H2 + O2=2H2O设制一个化学电池(材料均用碳棒),回答下列问题:
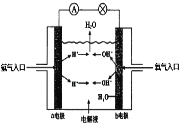
该电池的a极是______,(填正极或负极),若电解质溶液是稀硫酸,则![]() 移向______极,(填a或b),写出b极上的电极反应式________________.
移向______极,(填a或b),写出b极上的电极反应式________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物(a)![]() 的说法错误的是
的说法错误的是
A.a、b、c的分子式均为C8H8
B.b的所有原子可能处于同一平面
C.c的二氯代物有4种
D.a、b、c均能使溴水和酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组设计的糖厂甘蔗渣利用方案如下图所示:其中:A是植物生长调节剂,B是高分子化合物,D是具有水果香味的物质。请回答以下问题:
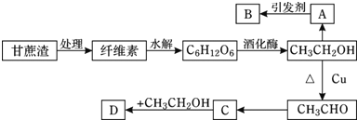
(1)纤维素的化学式为________,是________(填“纯净物”或“混合物”)。
(2)B的结构简式为________,C中官能团的名称为________。
(3)写出下列转化的化学方程式:CH3CH2OH→CH3CHO:_______,反应类型为________。
(4)化学式为C5H10O2的同分异构体中是C的同系物的有______种,其中在核磁共振氢谱上只有2个峰,且峰面积之比为1:9的结构简式为_______。
(5)下列说法正确的是________(填字母)。
A.生产A的主要方法是石油裂解,其产量是衡量一个国家石油化工水平的标志之一
B.分馏石油得到的各个馏分为纯净物
C.B可用于制造食品包装袋
D.塑料、合成纤维、合成橡胶等都是合成有机高分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某物质可溶于水、乙醇,熔点为209.5℃,其分子的结构简式如图,下列说法不正确的是( )
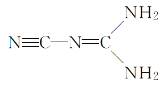
A.该分子与水分子可以形成氢键
B.该分子中原子最外层均达到8电子稳定结构的为C、N
C.1mol该物质中σ键和π键的个数比为5:3
D.该分子中C原子的杂化方式有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO的催化氧化在消除环境污染、净化空气等方面有重要价值。最新研究发现:常温下CO在Au/BN表面很难被O2氧化,但在H2O的参与下反应很容易发生,转化示意图如图:
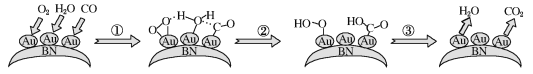
下列说法正确的是( )
A.CO2和H2O均只含极性共价键,且为极性分子
B.过程①有氢键形成
C.催化剂可以改变反应的路径,但不会改变反应速率和限度
D.在H2O和Au/BN的共同作用下,CO易被O2氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语对事实的解释不正确的是
A.NaHS水溶液显碱性:HS-+H2OS2-+H3O+
B.苯酚能溶于Na2CO3溶液:C6H5OH+CO32-=C6H5O-+HCO3-
C.三元催化剂净化汽车尾气中的NO和CO:2NO+2CO![]() 2CO2+N2
2CO2+N2
D.铜矿淋溶液(CuSO4)遇方铅矿(PbS)发生沉积:Cu2++SO42-+PbS=CuS+PbSO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com