
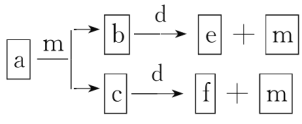
【题目】短周期元素W、X、Y、Z的原子序数依次增大,a、b、c、d、e、f是由这些元素组成的化合物,d是淡黄色粉末,m为元素Y的单质,通常为无色无味的气体。上述物质的转化关系如图所示。下列说法错误的是( )
A.简单离子半径:Z<Y
B.第一电离能:Y<X
C.m中存在离子键和极性键
D.W2Y2中含有非极性键,为极性分子
【答案】BC
【解析】
d是淡黄色粉末,则d为Na2O2;m为元素Y的单质,通常为无色无味的气体,则m为O2。短周期元素W、X、Y、Z的原子序数依次增大,则Y为O元素,Z为Na元素;由a的燃烧产生b、c都能与Na2O2反应生成O2,可确定它们为CO2、H2O中的某一种,从而确定a为烃或烃的C、H、O衍生物,W为H元素,X为C元素。
A.Y为O元素,Z为Na元素,Na+和O2-的电子层结构相同,核电荷数越大,离子半径越小,Na的核电荷数为11,O的核电荷数为8,则简单离子半径:Na+<O2-,A正确;
B.Y为O元素,X为C元素,非金属性O>C,则第一电离能:O>C,B错误;
C.m为O元素形成的单质O2,分子中只存在非极性键,不存在离子键和极性键,C错误;
D.W2Y2为H2O2,分子中含有O-O非极性键和O-H极性键,分子结构不对称,为极性分子,D正确;
故选BC。


科目:高中化学 来源: 题型:
【题目】海洋中有丰富的矿产、能源和水产资源,如图所示利用海水的部分流程。
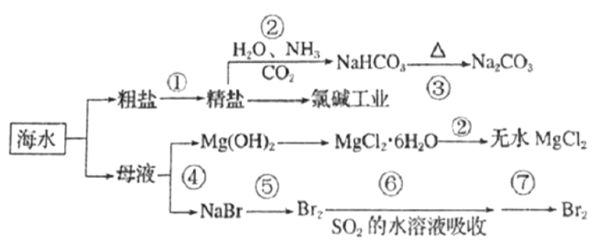
下列有关说法正确的是( )
A. 步骤②制取NaHCO3的原理是利用其溶解度比较小
B. 步骤②属于化合反应,步骤③属于分解反应
C. 在⑤⑥⑦步骤中,溴元素均被氧化
D. 工业上通过电解饱和MgCl2溶液制取金属镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某物质可溶于水、乙醇,熔点为209.5℃,其分子的结构简式如图,下列说法不正确的是( )
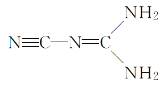
A.该分子与水分子可以形成氢键
B.该分子中原子最外层均达到8电子稳定结构的为C、N
C.1mol该物质中σ键和π键的个数比为5:3
D.该分子中C原子的杂化方式有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组微粒的空间构型相同的共有几个( )
①NH3和H2O ②BF3和H3O+ ③NH3和H3O+ ④O3和SO2 ⑤CO2和BeCl2 ⑥![]() 和
和![]() ⑦NF3和Al2Cl6
⑦NF3和Al2Cl6
A.6B.5C.4D.3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO的催化氧化在消除环境污染、净化空气等方面有重要价值。最新研究发现:常温下CO在Au/BN表面很难被O2氧化,但在H2O的参与下反应很容易发生,转化示意图如图:
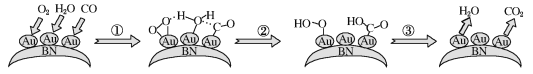
下列说法正确的是( )
A.CO2和H2O均只含极性共价键,且为极性分子
B.过程①有氢键形成
C.催化剂可以改变反应的路径,但不会改变反应速率和限度
D.在H2O和Au/BN的共同作用下,CO易被O2氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂离子电池是指以锂离子嵌入化合物为正极材料的电池。研究锂离子电池的电极材料、电解液具有重要的现实意义。
(1)锂离子电池的正极材料大多采用橄榄石型的LiMPO4(M=Fe、Co等元素)。
①Li+能量最低的激发态的电子排布图为______________________。
②第四电离能I4(Co)比I4(Fe)小,原因是______________________。
(2)锂离子电池的电解液有LiBF4等,碳酸亚乙酯(![]() )用作该电解液的添加剂。
)用作该电解液的添加剂。
①LiBF4中阴离子的空间构型为____________________。
②碳酸亚乙酯分子中碳原子的杂化方式为___________________;碳酸亚乙酯能溶于水的原因是______________________________________________________。
(3)硫化锂是目前正在研发的锂离子电池的新型固体电解质,为立方晶系晶体,其晶胞参数为apm。该晶胞中离子的分数坐标为:
硫离子:(0,0,0);(![]() ),
),![]() ;
;![]() ;……
;……
锂离子:![]() ;
;![]() ;
;![]() ;
;![]() ;……
;……
①在图上画出硫化锂晶胞沿x轴投影的俯视图。___________
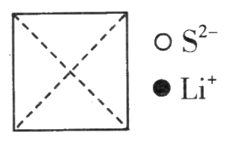
②硫离子的配位数为__________________。
③设NA为阿伏加德罗常数的值,硫化锂的晶体密度为________g·cm-3(列出计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】举世闻名的侯氏制碱法的工艺流程如下图所示,下列说法正确的是( )

A.往母液中加入食盐的主要目的是使![]() 更多的析出
更多的析出
B.从母液中经过循环Ⅰ进入沉淀池的主要是![]() 、
、![]() 和氨水
和氨水
C.沉淀池中反应的化学方程式:![]()
D.设计循环Ⅱ的目的是使原料氯化钠的利用率大大提升
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗的值, 已知HCl气体的质量为3.65g
(1)HCl的物质的量为_______________
(2)HCl的分子个数为_______________
(3)原子总数为 _______________
(4)在标准状况的体积为________________
(5)所含电子数为 _________________
(6)如把 HCl完全溶于水配置成1L 溶液,该溶液中H+的物质的量浓度为_________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com