
分析 (1)氯气氧化性强于溴单质,氯气与溴离子反应生成溴单质和氯离子,据此写出反应的离子方程式;
(2)溴单质与纯碱溶液反应生成溴化钠、溴酸钠和二氧化碳气体,据此写出反应的化学方程式;
(3)依据溴单质在四氯化碳中的溶解度大,可以利用有机溶剂萃取溴单质,分离得到溴单质,将(2)所得溶液用H2SO4酸化,使NaBr,NaBrO3中的溴转化为单质溴和硫酸钠,该反应中溴元素化合价向中间靠拢,根据化合价升降法配平该方程式;
(4)根据氯气能够与溴化钠反应生成氯化钠和溴单质,可以除去杂质氯气,溴单质易挥发,加热蒸馏得到纯净液溴.
解答 解:(1)通入氯气后,氯气与溴离子反应生成单质溴和溴离子,其离子方程式为:Cl2+2Br-═2Cl-+Br2,
故答案为:Cl2+2Br-═2 Cl-+Br2;
(2)纯碱溶液吸收Br2的化学方程式为:3Na2CO3+3Br2=5NaBr+NaBrO3+3CO2↑,
故答案为:3Na2CO3+3Br2=5NaBr+NaBrO3+3CO2↑;
(3)将(2)所得溶液用H2SO4酸化,使NaBr,NaBrO3中的溴转化为单质溴和硫酸钠,溴酸根离子中溴元素化合价为+5价变成0价,化合价降低5价;溴离子化合价由-1价到0价,化合价升高1价,则化合价变化的最小公倍数为5,所以溴酸根离子计量数为1,溴离子计量数为5,再根据观察法配平,配平后反应的化学方程式为:5NaBr+NaBrO3+3H2SO4=3Na2SO4+3Br 2+3H2O
故答案为:萃取;5NaBr+NaBrO3+3H2SO4=3Na2SO4+3Br 2+3H2O;
(4)利用NaBr溶液与Cl2反应生成溴单质和氯离子,然后分液可除去Cl2,溴单质是易挥发的液体,通过蒸馏得到溴单质,
故答案为:NaBr;蒸馏.
点评 本题考查了氯、溴、碘及其化合物的性质,题目难度中等,试题涉及了离子方程式、化学方程式、氧化还原反应的配平等知识,注意掌握卤素单质化学性质及相互之间发生置换反应.


科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
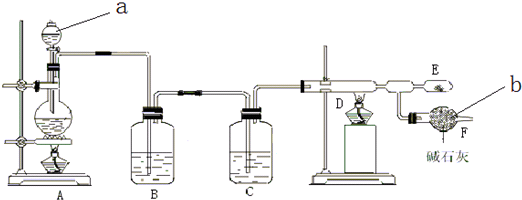
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 气化反应式 | lgK | ||
| 700K | 900K | 1200K | |
| C(s)+H2O(g)=CO(g)+H2(g) | -2.64 | -0.39 | 1.58 |
| C(s)+2H2O(g)=CO2(g)+2H2(g) | -1.67 | -0.03 | 1.44 |


查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的N2和CO含有相同数目的原子 | |
| B. | 1mol臭氧和1.5mol氧气含有相同的氧原子数 | |
| C. | 1mol氧气中含有12.04×1023个氧原子,在常温常压下占有体积22.4L | |
| D. | 等物质的量的干冰和葡萄糖(C6H12O6)中所含碳原子数之比为1:6,氧原子数之比为1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
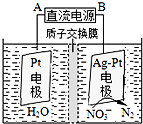 为治理环境,减少雾霾,工业上通常用下列方法治理CO2和硫、氮氧化物的污染.
为治理环境,减少雾霾,工业上通常用下列方法治理CO2和硫、氮氧化物的污染.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com