
| A、常温常压下,11.2 LCO2所含的原子数为1.5NA | ||
B、标准状况下,1 L水所含分子数为
| ||
| C、标准状况下,22.4 L H2中所含原子数为NA | ||
| D、常温常压下,48 g O3含有的氧原子数为3NA |
| 48g |
| 48g/mol |


 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案 培优三好生系列答案
培优三好生系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有大量Fe3+的溶液中:NH4+、Na+、Cl-、OH- |
| B、在强碱溶液中:Na+、K+、ClO-、CO32- |
| C、在强酸的溶液中:K+、Fe2+、Cl-、NO3- |
| D、在强碱的溶液中:K+、Na+、Ca2+、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓H2SO4沾到皮肤上,必须迅速用大量氢氧化钠溶液冲洗 |
| B、取用化学药品时,应特别注意观察药品包装上的安全警示标志 |
| C、凡是给玻璃仪器加热,都要垫石棉网,以防仪器炸裂 |
| D、闻某些化学药品的气味时可以使鼻子凑近药品直接闻 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4He原子核内含有4个质子 |
| B、3He和4He互为同位素 |
| C、3He原子核内含有3个中子 |
| D、4He的最外层电子数为2,故 4He具有较强的金属性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
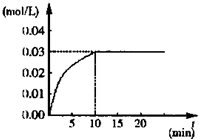 在某一容积为5L的密闭容器内,加入3mol的CO和0.3mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H>0,反应中CO2的浓度随时间变化情况如图:
在某一容积为5L的密闭容器内,加入3mol的CO和0.3mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H>0,反应中CO2的浓度随时间变化情况如图:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com