
已知298K时下述反应的有关数据: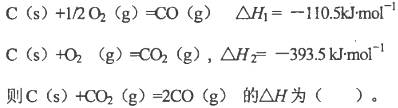

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:单选题
已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1
H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1
下列说法正确的是( )
| A.H2(g)的燃烧热为 -571.6 kJ·mol-1 |
| B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多 |
C.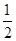 H2SO4(aq)+ H2SO4(aq)+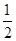 Ba(OH)2(aq)= Ba(OH)2(aq)= 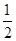 BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1 BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1 |
| D.3H2(g)+CO2(g)= CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在25℃、101 kPa条件下,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5kJ/mol、285.8kJ/mol、870.3kJ/mol,则2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应热为 ( )
| A.-488.3 kJ/mol | B.+488.3 kJ/mol |
| C.-191 kJ/mol | D.+191 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
向足量H2SO4溶液中加入110 mL 0.4 mol/L Ba(OH)2溶液,放出的热量是5.12 kJ。如果向足量Ba(OH)2溶液中加入110 mL 0.4 mol/L HCl溶液时,放出的热量是2.2 kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为( )
| A.Ba2+(aq)+SO42—(aq)=BaSO4(s)ΔH=-0.72 kJ/mol |
| B.Ba2+(aq)+SO42—(aq)=BaSO4(s)ΔH=-2.92 kJ/mol |
| C.Ba2+(aq)+SO42—(aq)=BaSO4(s)ΔH=-16.4 kJ/mol |
| D.Ba2+(aq)+SO42—(aq)=BaSO4(s)ΔH=-73.0 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的一种反应原理如下:CH3OH(g)+H2O(g)=CO2(g)+3H2(g)ΔH=+49.0 kJ·mol-1
下列说法正确的是( )
| A.1 L CH3OH蒸汽与1 L水蒸气反应生成1 L CO2气体与3 L氢气吸收热量49.0 kJ |
| B.1个CH3OH分子与1个水分子反应生成1个CO2分子与3个H2分子吸收49.0 kJ热量 |
| C.相同条件下1 mol CH3OH(g)与1 mol H2O(g)的能量总和小于1 mol CO2(g)与3 mol H2(g)的能量总和 |
| D.1 mol CH3OH蒸汽与1 mol液态水反应生成1 mol CO2气体与3 mol氢气吸收的热量小于49.0 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列热化学方程式中,正确的是( )
A.甲烷的燃烧热ΔH为-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g) CO2(g)+2H2O(g) ΔH="-890.3" kJ·mol-1 CO2(g)+2H2O(g) ΔH="-890.3" kJ·mol-1 |
B.含20.0 g的NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ 的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq) CH3COONa(aq)+H2O(l) ΔH="-57.4" kJ·mol-1 CH3COONa(aq)+H2O(l) ΔH="-57.4" kJ·mol-1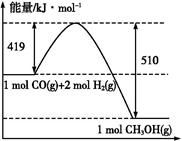 |
C.上图是298 K、101 Pa时CO和H2合成CH3OH(g)的反应过程中能量变化的曲线图,则该反应的热化学方程式为:CO(g)+2H2(g) CH3OH(g) ΔH="+91" kJ·mol-1 CH3OH(g) ΔH="+91" kJ·mol-1 |
D.已知:2Zn(s)+O2(g) 2ZnO(s) ΔH="-701.0" kJ/mol 2ZnO(s) ΔH="-701.0" kJ/mol |
 2HgO(s) ΔH="-181.6" kJ/mol
2HgO(s) ΔH="-181.6" kJ/mol ZnO(s)+Hg(l) ΔH="-259.7" kJ·mol-1
ZnO(s)+Hg(l) ΔH="-259.7" kJ·mol-1查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法或表示方法不正确的是( )
| A.盖斯定律实质上是能量守恒定律的体现 |
| B.在稀溶液中:H+(aq)+OH-(aq)=H2O(l);ΔH= -57.3 kJ/mol,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ |
| C.由C(石墨)―→C(金刚石);ΔH=+73 kJ/mol,可知石墨比金刚石稳定 |
| D.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l);ΔH=-285.8 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知:NH3·H2O(aq)与H2SO4(aq)反应生成1 mol正盐的ΔH=-24.2 kJ·mol-1;强酸、强碱的稀溶液反应的中和热为ΔH=-57.3 kJ·mol-1。则NH3·H2O在水溶液中电离的ΔH等于( )
| A.-69.4 kJ·mol-1 | B.-45.2 kJ·mol-1 |
| C.+69.4 kJ·mol-1 | D.+45.2 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
实验室中制备乙烯的方法是使乙醇脱水,反应可以简单地表示为CH3CH2OH―→CH2=CH2↑+H2O。已知CH2=CH2(g)和C2H5OH(l)的燃烧热分别是1 411.0 kJ·mol-1和1 366.8 kJ·mol-1。则实验室用C2H5OH(l)制备CH2=CH2(g)生成1 mol液态水的ΔH为( )
| A.-44.2 kJ·mol-1 |
| B.+44.2 kJ·mol-1 |
| C.-2 777.8 kJ·mol-1 |
| D.+2 777.8 kJ·mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com