
下列热化学方程式中,正确的是( )
A.甲烷的燃烧热ΔH为-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g) CO2(g)+2H2O(g) ΔH="-890.3" kJ·mol-1 CO2(g)+2H2O(g) ΔH="-890.3" kJ·mol-1 |
B.含20.0 g的NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ 的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq) CH3COONa(aq)+H2O(l) ΔH="-57.4" kJ·mol-1 CH3COONa(aq)+H2O(l) ΔH="-57.4" kJ·mol-1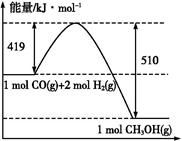 |
C.上图是298 K、101 Pa时CO和H2合成CH3OH(g)的反应过程中能量变化的曲线图,则该反应的热化学方程式为:CO(g)+2H2(g) CH3OH(g) ΔH="+91" kJ·mol-1 CH3OH(g) ΔH="+91" kJ·mol-1 |
D.已知:2Zn(s)+O2(g) 2ZnO(s) ΔH="-701.0" kJ/mol 2ZnO(s) ΔH="-701.0" kJ/mol |
 2HgO(s) ΔH="-181.6" kJ/mol
2HgO(s) ΔH="-181.6" kJ/mol ZnO(s)+Hg(l) ΔH="-259.7" kJ·mol-1
ZnO(s)+Hg(l) ΔH="-259.7" kJ·mol-1  全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:单选题
已知乙炔与苯蒸气完全燃烧的热化学方程式如下:
①C2H2(g)+ O2(g)―→2CO2(g)+H2O(l) ΔH=-1 300 kJ·mol-1
O2(g)―→2CO2(g)+H2O(l) ΔH=-1 300 kJ·mol-1
②C6H6(g)+ O2(g)―→6CO2(g)+3H2O(l) ΔH=-3 295 kJ·mol-1
O2(g)―→6CO2(g)+3H2O(l) ΔH=-3 295 kJ·mol-1
下列说法正确的是 ( )。
| A.1 mol C2H2(g)完全燃烧生成气态水时放热大于1 300 kJ |
| B.1 mol C6H6(l)完全燃烧生成液态水时放热大于3 295 kJ |
| C.相同条件下,等质量的C2H2(g)与C6H6(g)完全燃烧,C6H6(g)放热更多 |
| D.C2H2(g)三聚生成C6H6(g)的过程属于放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下图表示化学反应过程中的能量变化,据图判断下列说法中合理的是( )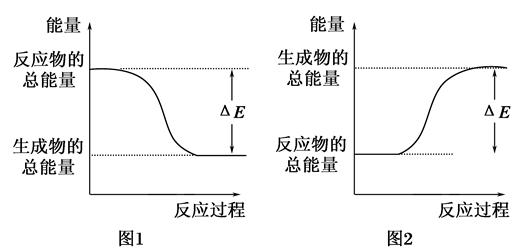
| A.500mL 2.0mol·L-1 HCl和500mL 2.0mol·L-1 NaOH的反应符合图1,且ΔE=57.3kJ |
| B.500mL 2.0mol·L-1 H2SO4和500mL 2.0mol·L-1 Ba(OH)2的反应符合图2,且ΔE=114.6kJ |
| C.发生图1能量变化的任何反应,一定不需加热即可发生 |
| D.CaO、浓硫酸溶于水时的能量变化符合图1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法正确的是( )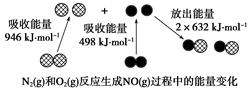
| A.1 mol N2(g)和NA个O2(g)反应放出的能量为180 kJ |
| B.1 mol N2(g)和1 mol O2(g)具有总能量小于2 mol NO(g)具有的总能量 |
| C.通常情况下,N2(g)和O2(g)混合能直接生成NO |
| D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列各组热化学方程式中,Q1<Q2的是( )
| A.CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-Q1 kJ·mol-1 CH4(g)+3/2O2(g)=CO(g)+2H2O(g) ΔH=-Q2 kJ·mol-1 |
| B.S(g)+O2(g)=SO2(g) ΔH=-Q1 kJ·mol-1 S(s)+O2(g)=SO2(g) ΔH=-Q2 kJ·mol-1 |
| C.H2(g)+Br2(g)=2HBr(g) ΔH=-Q1 kJ·mol-1 H2(g)+Cl2(g)=2HCl(g) ΔH=-Q2 kJ·mol-1 |
| D.HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l) ΔH=-Q1 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
甲醛是一种重要的化工产品,可以利用甲醇脱氢制备,反应式如下:
①CH3OH(g) CH2O(g)+H2(g) ΔH1="+84.2" kJ·mol-1
CH2O(g)+H2(g) ΔH1="+84.2" kJ·mol-1
向反应体系中通入氧气,通过反应②2H2(g)+O2(g) 2H2O(g) ΔH2="-483.6" kJ·mol-1提供反应①所需热量,要使反应温度维持在700 ℃,则进料中甲醇与氧气的物质的量之比约为( )
2H2O(g) ΔH2="-483.6" kJ·mol-1提供反应①所需热量,要使反应温度维持在700 ℃,则进料中甲醇与氧气的物质的量之比约为( )
| A.5.74∶1 | B.11.48∶1 | C.1∶1 | D.2∶1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某反应的ΔH=+100 kJ·mol-1,下列有关该反应的叙述正确的是( )
| A.正反应活化能小于100 kJ·mol-1 |
| B.逆反应活化能一定小于100 kJ·mol-1 |
| C.正反应活化能不小于100 kJ·mol-1 |
| D.正反应活化能比逆反应活化能大100 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
25 ℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是ΔH=-393.5 kJ/mol、ΔH=-285.8 kJ/mol、ΔH=-890.3 kJ/mol、ΔH=-2 800 kJ/mol,则下列热化学方程式正确的是( )
A.C(s)+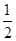 O2(g)=CO(g)ΔH=-393.5 kJ/mol O2(g)=CO(g)ΔH=-393.5 kJ/mol |
| B.2H2(g)+O2(g)=2H2O(l)ΔH=-571.6 kJ/mol |
| C.CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH=-890.3 kJ/mol |
D.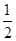 C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(g)ΔH=-1 400 kJ/mol C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(g)ΔH=-1 400 kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com