
| A. | 在Na2B溶液中一定有:c(OH-)=c(H+)+c(HB-)+2c(H2B) | |
| B. | NaHB溶液可能存在以下关系:c(Na+)>c(HB-)>c(OH-)>c(H+) | |
| C. | NaHB水溶液中一定有:c(Na+)+c(H+)=c(HB-)+c(OH-)+c(B2-) | |
| D. | NaHB溶液一定呈酸性,Na2B溶液一定呈碱性 |
分析 酸H2B在水溶液中第一步完全电离,第二步部分电离,所以B2-只能发生一步水解,
A.B2-只能发生一步水解,所以溶液中不存在H2B;
B.HB-在水溶液里只能电离不能水解,导致溶液呈酸性;
C.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
D.HB-在水溶液里只能电离不能水解,B2-只能发生一步水解.
解答 解:酸H2B在水溶液中第一步完全电离,第二步部分电离,所以B2-只能发生一步水解,
A.B2-只能发生一步水解,所以溶液中不存在H2B,溶液中存在质子守恒c(OH-)=c(H+)+c(HB-),故A错误;
B.HB-在水溶液里只能电离不能水解,导致溶液呈酸性,所以c(OH-)<c(H+),故B错误;
C.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(HB-)+c(OH-)+2c(B2-),故C错误;
D.HB-在水溶液里只能电离不能水解,B2-只能发生一步水解,所以NaHB溶液一定呈酸性,Na2B溶液一定呈碱性,故D正确;
故选D.
点评 本题考查离子浓度大小比较,明确该二元酸电离特点是解本题关键,再结合守恒思想解答,注意B2-只能发生一步水解,HB-只发生电离不水解,为易错点.


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:选择题
| A. | H2的燃烧热为241.8 kJ•mol-1 | |
| B. | 2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ•mol-1 | |
| C. | 1 mol H2完全燃烧生成液态水放出的热量大于241.8 kJ | |
| D. | 断开1 mol H2O的化学键吸收的总能量大于断裂1 mol H2和0.5 mol O2的化学键所吸收的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 H2S利用是回收能最并得到单质硫.反应原理为:2H2S(g)+02(g)═S2(s)+2H20(1)△H=-632kJ•mol-1.下图为质子膜H2S燃料电池示意图.下列说法正确的是( )
H2S利用是回收能最并得到单质硫.反应原理为:2H2S(g)+02(g)═S2(s)+2H20(1)△H=-632kJ•mol-1.下图为质子膜H2S燃料电池示意图.下列说法正确的是( )| A. | 该电池可实现把化学能全部转化为电能 | |
| B. | 电极b上发生的电极反应为:02+2H2O+4e-═40H- | |
| C. | 电极a上发生的电极反应为:2H2S-4e-═S2+4H+ | |
| D. | 当有34gH2S参与反应时,有2mo1H+经质子膜进人负极区 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
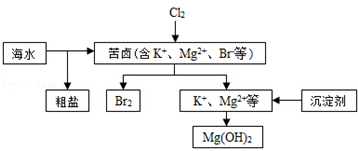
| A. | 向苦卤中通入Cl2是为了提取溴 | |
| B. | 粗盐可采用除杂、过滤、蒸发结晶等过程提纯 | |
| C. | 工业生产常选用NaOH作为沉淀剂 | |
| D. | 单质溴可用SO2将其还原吸收 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.8g | B. | 6.3g | C. | 5.6g | D. | 11.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ③④⑥ | C. | ②④⑤ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
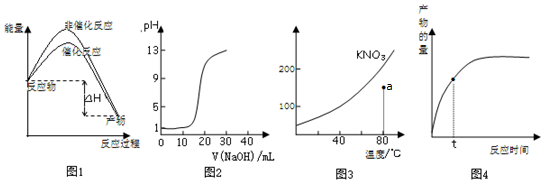
| A. | 图1表示加入催化剂不影响反应的焓变 | |
| B. | 图2表示用0.10mol/L CH3COOH溶液滴定20.00 mL0.10mol/LNaOH溶液所得到的滴定曲线 | |
| C. | 图3表示KNO3的溶解度曲线,图中点所示的溶液是80℃时KNO3的不饱和溶液 | |
| D. | 图4表示t时正反应速率大于逆反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示,隔板K1固定不动,活塞K2可自由移动.T℃时,M、N两个容器中均发生反应N2(g)+3H2(g)?2NH3(g),向容器M、N中各充入l mol N2和3mol H2,初始M、N的容积和温度相同,并保持温度不变.下列说法中不正确的是( )
如图所示,隔板K1固定不动,活塞K2可自由移动.T℃时,M、N两个容器中均发生反应N2(g)+3H2(g)?2NH3(g),向容器M、N中各充入l mol N2和3mol H2,初始M、N的容积和温度相同,并保持温度不变.下列说法中不正确的是( )| A. | 反应达到平衡时N2的转化率:M<N | B. | H2的体积分数:M<N | ||
| C. | NH3的浓度:M<N | D. | 该反应在T℃时的平衡常数K:M=N |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com