
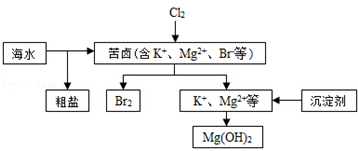
| A. | 向苦卤中通入Cl2是为了提取溴 | |
| B. | 粗盐可采用除杂、过滤、蒸发结晶等过程提纯 | |
| C. | 工业生产常选用NaOH作为沉淀剂 | |
| D. | 单质溴可用SO2将其还原吸收 |
分析 A.向苦卤中通入Cl2置换出溴单质,分离得到溴;
B.粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时应加入试剂进行除杂,过滤后向滤液中加入盐酸至溶液呈中性,再进行蒸发结晶进行提纯;
C.工业常选用生石灰或石灰水作沉淀剂;
D.先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收转化为HBr,达到富集的目的.
解答 解:A.向苦卤中通入Cl2置换出溴单质,分离得到溴,通入Cl2是为了提取溴,故A正确;
B.粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时通常在溶液中依次中加入过量的BaCl2溶液、过量的NaOH溶液和过量的Na2CO3溶液,过滤后向滤液中加入盐酸至溶液呈中性,再进行蒸发结晶进行提纯,故B正确;
C.海边有大量贝壳,其主要成分为碳酸钙,工业常选用生石灰或石灰水作沉淀剂,故C错误;
D.海水提取溴一般用氯气置换溴离子转化为溴单质,用空气和水蒸气吹出单质溴,再用SO2将其还原吸收转化为HBr,达到富集的目的,故D正确;
故选C.
点评 本题考查海水资源的综合利用,注意掌握中学常见的化学工业,侧重对化学与技术的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用酸性KMnO4溶液鉴别CH3CH3和CH2=CH2 | |
| B. | 将盛有等体积CH4和Cl2的大试管倒扣在水槽中光照,试管内不能充满液体 | |
| C. | 用NaOH溶液除去乙酸乙酯中的少量乙酸 | |
| D. | 用NaOH溶液和新制Cu(OH)2悬浊液检验淀粉在稀H2SO4作用下是否水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各 种性能的不锈钢,CrO3大量地用于电镀工业中.
铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各 种性能的不锈钢,CrO3大量地用于电镀工业中.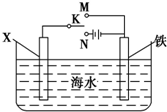 ,可以模拟铁的电化学防护.若 X 为碳棒,为减缓铁的腐蚀,开关 K 应置于N处.若 X 为锌,开关K 置于N或M处.
,可以模拟铁的电化学防护.若 X 为碳棒,为减缓铁的腐蚀,开关 K 应置于N处.若 X 为锌,开关K 置于N或M处.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2溶于水生成的H2SiO3的酸性弱于H2CO3 | |
| B. | SiO2是一种空间立体网状结构的晶体,熔点高、硬度大 | |
| C. | 在SiO2晶体中,每个硅原子周围结合2个氧原子 | |
| D. | SiO2是一种酸性氧化物,所以不和任何酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,一氧化氮能与空气中的氧气直接化合 | |
| B. | SiO2与酸、碱均不反应 | |
| C. | Na2O、Na2O2组成元素相同,两化合物都为碱性氧化物 | |
| D. | NO2通入FeSO4溶液中始终无明显现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在Na2B溶液中一定有:c(OH-)=c(H+)+c(HB-)+2c(H2B) | |
| B. | NaHB溶液可能存在以下关系:c(Na+)>c(HB-)>c(OH-)>c(H+) | |
| C. | NaHB水溶液中一定有:c(Na+)+c(H+)=c(HB-)+c(OH-)+c(B2-) | |
| D. | NaHB溶液一定呈酸性,Na2B溶液一定呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②③④ | C. | ②③⑤ | D. | ①③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中滴加NaOH溶液并加热,用湿润的蓝色石蕊试纸于试管口以检验NH4+ | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加入盐酸,沉淀不消失,一定有SO42- | |
| C. | 某待测液焰色反应呈黄色,则待测液中一定不含有K+ | |
| D. | 某溶液中加入KSCN后,溶液无变化,再加入H2O2后,溶液变成血红色,说明原溶液中一定含有Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com