
【题目】强酸性溶液X中可能含有Na+ , K+、NH4+、 Fe3+、Fe2+、Al3+、CO32-、 SO32-、SO42-、C1-的若干种,某同学为了确认其成分,取X溶液进行连 续实验,实验过程及产物如下所示:
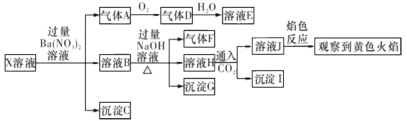
下列结论止确的是
A.气体A是SO2,证明原溶液中含有SO32-
B.沉淀G中加人盐酸溶解,滴加KSCN溶液显红色,可以确定原溶液中 有Fe3+
C.沉淀I―定是A1(OH)3
D.X中不能确定的离子是Al3+、Fe3+ 、Na+ 、K +和Cl-
【答案】D
【解析】
①强酸性溶液中CO32、SO32不能存在;②X溶液中加入过量Ba(NO3)2溶液生成沉淀C是BaSO4,说明有SO42存在;硝酸被还原生成气体A为NO,说明有还原剂Fe2+存在,(即3Fe2++4H++NO3-=3Fe3++NO↑+2H2O),在此反应中,Fe2+被氧化为Fe3+。③溶液B加入过量NaOH溶液,生成的沉淀G为Fe(OH)3;生成的气体F为NH3;说明有NH4+存在。④溶液H通入CO2生成沉淀I,由于前面加入过量的Ba(NO3)2溶液,引入了大量Ba2+,且前面加入的NaOH是过量的,所以沉淀I中一定有BaCO3,又由于前面不能确定溶液X中是否存在A13+,所以这里也不能确定沉淀I中有A1(OH)3;溶液J的焰色反应呈黄色,说明溶液J中有Na+,但由于前面加入过量NaOH溶液,引入了较多的Na+,因此不能确定溶液X中是否存在Na+;因为焰色黄色能掩盖紫色焰色,所以不能确定溶液X中是否有K+;另外,上述实验过程还不能确定溶液X中是否存在C1;
A. 强酸性溶液X中CO32-、SO32-不能存在,故A错误.
B. 沉淀G为Fe(OH)3,但Fe3+可能是原来有的,也可能是Fe2+被氧化生成的,故B错误;
C. 溶液H通入CO2生成沉淀I,由于前面加入过量的Ba(NO3)2溶液,引入了大量Ba2+,且前面加入的NaOH是过量的,所以沉淀I中一定有BaCO3,又由于前面不能确定溶液X中是否存在A13+,所以这里也不能确定沉淀I中有A1(OH)3,故C错误;
D. 溶液J的焰色反应呈黄色,说明溶液J中有Na+,但由于前面加入过量NaOH溶液,引入了较多的Na+,因此不能确定溶液X中是否存在Na+;因为焰色黄色能掩盖紫色焰色,所以不能确定溶液X中是否有K+;另外,上述实验过程还不能确定溶液X中是否存在C1,故D正确;
答案选D。


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向苯酚浊液中滴加Na2CO3溶液,浊液变清 | 苯酚的酸性强于H2CO3的酸性 |
B | 向碘水中加入等体积CCl4,振荡后静置,上层接近无色,下层显紫红色 | I2在CCl4中的溶解度大于在水中的溶解度 |
C | 向CuSO4溶液中加入铁粉,有红色固体析出 | Fe2+的氧化性强于Cu2+的氧化性 |
D | 向NaCl、NaI的混合稀溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成 | Ksp(AgCl) >Ksp(AgI) |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗品并精制流程:

依照上述流程回答以下问题:
(1)混合①中发生反应的化学方程式为_______。
(2)操作Ⅱ和操作Ⅲ的名称分别是_______、_______。操作Ⅲ一般适用于分离____________混合物。〔选填编号〕
a、固体和液体b、固体和固体c、互不相溶的液体d、互溶的液体
(3)混合②中加入Na2SO3的目的是_______。
(4)纯净的氢溴酸应为无色液体,但实际工业生产中制得的氢溴酸〔工业氢溴酸〕带有淡淡的黄色。因此甲乙两同学设计了简单实验加以探究:甲同学假设工业氢溴酸呈淡黄色是因为含Fe3+,那么用于证明该假设所用的试剂的名称为_______。乙同学假设工业氢溴酸呈淡黄色是因为________,其用于证明该假设所用的试剂的化学式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科学家利用二氧化饰(CeO2)在太阳能作用下将H2O、CO2转变为H2、 CO,其过程如下所示:
mCeO2![]() (m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+x H2O+xCO2![]() mCeO2+xH2+xCO2
mCeO2+xH2+xCO2
下列说法不正确的是
A.该过程中CeO2是H2O、CO2转变为H2、CO反应的催化剂
B.利用CeO2作催化剂-既可使该转变过程速率提高。亦可减小能量的消 耗,并可提高反应物转化率
C.mmol CeO2参加反应,气体物质的量增加x mol
D.以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH - - 2e = CO32- +2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种粒子之间有如图所示的转化关系。根据图示转化关系推测下列说法正确的是
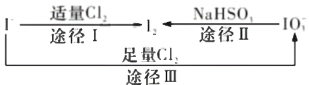
A.可用淀粉-KI试纸和食醋检验加碘盐中是否含有碘元素
B.向淀粉-KI溶液中通入过量Cl2,最终溶液呈蓝色
C.由图可知氧化性的强弱顺序为C12 >I2 >IO3-
D.途径1和II中各自生成1 mol I2,反应中转移的电子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制硫酸中的一步重要反应是SO2在400-500℃和常压下的催化氧化: 2SO2 + O2![]() 2SO3, 这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述相关说法中错误的是
2SO3, 这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述相关说法中错误的是
A.反应温度选择400-500℃是该反应催化剂的催化活性、反应速率、反应限度等角度综合考虑的结果
B.因为在常压下该反应的速率和SO2的转化率已经很高了,所以选择常压条件主要是从生产成本角度考虑
C.为提高SO2的转化率,应适当提高O2的浓度
D.使用催化剂是为了加快反应速率,提高SO3产率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯氧磷((POCl3)可用于制备增塑剂,常温下为无色透明液体,易挥发,易水解。一中化学兴趣小组探究制备POCl3所需的装置如下图所示:

反应原理:PCl3+Cl2+H2O![]() POCl3+2HCl(PC13常温下为液态,易挥发)。
POCl3+2HCl(PC13常温下为液态,易挥发)。
(1)仪器3的名称是 _________,仪器2中装入的物质为______,仪器I的作用是_____.
(2)请选择上述必要装置并组装,用小写字母连接:________________________。
(3)开始通入氯气。同时慢慢滴加水,控制氯气和水的质量比在3.94左右,理由是:________________________.
(4)上述装置有一处不足,请指岀该不足:__________________________.
(5)上述反应剩余PCl3可以继续通入Cl2,再和P4O10反应,也可以产生的POC13 .。 写出该反应的化学方程式:__________________________________ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向10 mL 0.1 mol/L醋酸溶液中加水稀释后,下列说法正确的是( )
A. 溶液中离子的数目减小
B. 再加入CH3COONa固体能促进醋酸的电离
C. 醋酸的电离程度增大,c(H+)亦增大
D. 溶液中c(CH3COO-)/c(CH3COOH)c(OH-)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行如下反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H=-764.5kJ·mol-1,达到平衡后,为提高反应的速率和NO的转化率,采取的正确措施是( )
N2(g)+2CO2(g) △H=-764.5kJ·mol-1,达到平衡后,为提高反应的速率和NO的转化率,采取的正确措施是( )
A.加催化剂同时升高温度
B.升高温度同时充入氮气
C.加催化剂同时增大压强
D.降低温度同时增大压强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com