
| A. | CO→CO2 | B. | FeCl2 →FeCl3 | C. | Na2SO3 →SO2 | D. | CuO→Cu |
科目:高中化学 来源: 题型:选择题
| A. | 0.40mol/L | B. | 0.30mol/L | C. | 0.075mol/L | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 应称量NaOH的质量/g | 应选用容量瓶的规格/mL | 除容量瓶外还需要的其它仪器 |
| 4.0 | 500 | 烧杯、量筒、玻璃棒、药匙、托盘天平、胶头滴管 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 失去电子的反应是还原反应 | |
| B. | 在氧化还原反应中不一定所有的元素的化合价都发生变化 | |
| C. | 做氧化剂的物质不能是还原剂 | |
| D. | 发生还原反应的元素对应产物是氧化产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁和硫酸铜溶液反应得到铜 | |
| B. | 铁和稀盐酸反应生成H2和FeCl2 | |
| C. | 铁高温下和水蒸气反应生成H2和Fe2O3 | |
| D. | 铁在氧气中燃烧生成Fe3O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
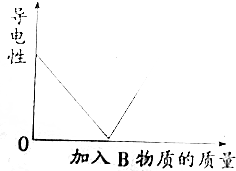 向某A溶液中加入一种物质B,其导电能力变化与加入B物质的质量关系符合如图曲线的是( )
向某A溶液中加入一种物质B,其导电能力变化与加入B物质的质量关系符合如图曲线的是( )| A. | 盐酸中滴加Ba(OH)2溶液至过量 | |
| B. | CaCl2溶液中滴加浓Na2CO3溶液至过量 | |
| C. | AgNO3溶液中滴加NaCl溶液至过量 | |
| D. | 稀硫酸中滴加Ba(OH)2溶液至过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
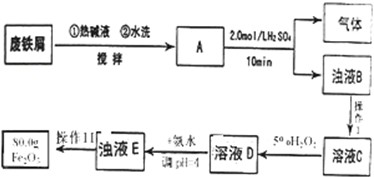
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com