
分析 (1)A.铜质搅拌棒会导热;
B.温度计要一直插在溶液中,观察最高温度;
C.分次加入混合时,容易造成热量损失;
D.为了使反应进行更完全,碱要过量.
(2)根据物质的物质的量与热量之间的关系以及热化学方程式的书写方法书写;
(3)醋酸是弱酸,电离过程需要吸热.
解答 解:A.铜质搅拌棒会导热,使热量被铜棒导出,烧杯内温度降低,温度差偏小,所得中和热的数值偏小,故A错误;
B.为了测量反应的最高温度,温度计要一直插在溶液中,故B正确;
C.分次加入混合时,容易造成热量损失,所得中和热的数值偏小,故C错误;
D.为了使反应进行更完全,碱可以适当过量,故D正确.
故选:AC;
(2)在稀溶液中,盐酸和氢氧化钠溶液发生中和反应生成1mol H2O时,放出57.3kJ的热量,则反应的热化学方程式为:NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.3 kJ/mol;
故答案为:NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.3 kJ/mol;
(3)醋酸是弱酸,电离过程需要吸热,所以测得的中和热数值会偏小,故答案为:偏小;醋酸电离要吸收热量.
点评 本题考查中和热的测定,题目难度不大,把握实验操作的规范性、实验细节和实验原理为解答的关键.


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
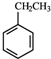 (g)+CO2(g)?
(g)+CO2(g)?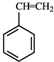 (g)+CO(g)+H2O(g)△H=-166KJ/mol
(g)+CO(g)+H2O(g)△H=-166KJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 具有下列电子排布式的原子中,①1s22s22p63s23p2②1s22s22p1${\;}^{2{2}^{3}}$③1s22s22p2④1s22s22p63s23p4 原子半径最大的是① | |
| B. | 具有下列价电子排布式的原子中,①3s23p1 ②3s23p 2 ③3s23p3 ④33s23p 4第一电离能最大是③ | |
| C. | ①Na、K、Rb ②N、P、Si ③Na、P、Cl,元素的电负性随原子序数增大而递增的是③ | |
| D. | 某主族元素气态基态原子的逐级电离能分别为738、1451、7733、10540、13630、17995、21703…,当它与氯气反应时生成的阳离子是X3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子最外层电子数大于4的元素可能是金属元素 | |
| B. | 含有共价键的物质一定是共价化合物 | |
| C. | 离子化合物中只可能含有离子键而不可能含有共价键 | |
| D. | 多种非金属元素之间形成的共价键一定是极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
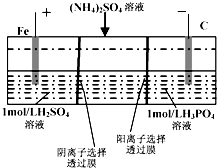 用一种阴、阳离子双隔膜三室电解槽处理废水中的NH4+,模拟装置如图所示.下列说法正确的是( )
用一种阴、阳离子双隔膜三室电解槽处理废水中的NH4+,模拟装置如图所示.下列说法正确的是( )| A. | 阳极室溶液由无色变成棕黄色 | |
| B. | 电解一段时间后,阴极室溶液中的pH升高 | |
| C. | 阴极的电极反应式为:4OH--4e-═2H2O+O2↑ | |
| D. | 电解一段时间后,阴极室溶液中的溶质一定是(NH4)3PO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氟酸具有强酸性,可用于雕刻玻璃 | |
| B. | 明矾净水是因为Al(OH)3胶体能消毒 | |
| C. | MgO、Al2O3熔点高,它们都可用于制作耐火材料 | |
| D. | 高纯度的硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com