


科目:高中化学 来源: 题型:
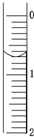 现使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).
现使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).| 滴定次数 实验数据(mL) |
1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
健康是人类社会永恒的主题,右图表示胰岛素与胰高血糖素在调节葡萄糖代谢中的相互关系,当血糖浓度降低时,激素①分泌量增加,请据图分析回答:
(1)正常人饭后血液中明显增多的激素是图中的________________。
(2)激素②的作用结果反过来会影响激素②的分泌,该调节方式称为_____________
___________________。
(3)图中的激素①是由_____________细胞分泌的。机体内_____________激素与激素①具有相同作用效果。
(4)有人试图通过研磨胰腺的方法获得激素②,均未获得成功,由图可知原因是_____
______________________________。
(5)为了探究动物体内甲状腺激素分泌的调节机理,某同学设计了如下实验:
知识准备:碘是合成甲状腺激素的原料。甲状腺是合成、贮存、分泌甲状腺激素的器官。
方法步骤:
第一步:取健康雄兔15只,注射部位消毒后,分别给每只兔注射适量的放射性碘溶液。
第二步:每隔一定时间用放射性测量仪分别测定每只兔子甲状腺中碘的放射量,记录并计算平均值。
第三步:3天后,将15只实验兔随机均分为A、B、C三组。
第四步:向A组注射一定量的无放射性的甲状腺激素溶液,向 B组注射等量的无放射性的促甲状腺激素溶液,向C组注射等量的生理盐水。
第五步:每隔一定时间,分别测定三组兔子甲状腺中碘的放射量,记录并计算平均值。
回答下列问题:
①指出上述实验方法步骤第一步中的两处不严谨之处:__________________________
_________________________________________________。
②如果实验步骤第一步改正后,实施整个实验,请你预测最终实验结果:
A、B、C三组兔子甲状腺中碘的放射量平均值从高到低排列的顺序是_____________。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年辽宁省锦州市高三检测三(理综)化学部分 题型:综合题
健康是人类社会永恒的主题,右图表示胰岛素与胰高血糖素在调节葡萄糖代谢中的相互关系,当血糖浓度降低时,激素①分泌量增加,请据图分析回答:
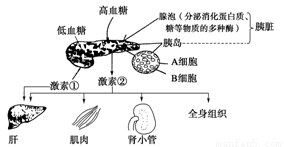
(1)正常人饭后血液中明显增多的激素是图中的________________。
(2)激素②的作用结果反过来会影响激素②的分泌,该调节方式称为_____________
___________________。
(3)图中的激素①是由_____________细胞分泌的。机体内_____________激素与激素①具有相同作用效果。
(4)有人试图通过研磨胰腺的方法获得激素②,均未获得成功,由图可知原因是_____
______________________________。
(5)为了探究动物体内甲状腺激素分泌的调节机理,某同学设计了如下实验:
知识准备:碘是合成甲状腺激素的原料。甲状腺是合成、贮存、分泌甲状腺激素的器官。
方法步骤:
第一步:取健康雄兔15只,注射部位消毒后,分别给每只兔注射适量的放射性碘溶液。
第二步:每隔一定时间用放射性测量仪分别测定每只兔子甲状腺中碘的放射量,记录并计算平均值。
第三步:3天后,将15只实验兔随机均分为A、B、C三组。
第四步:向A组注射一定量的无放射性的甲状腺激素溶液,向 B组注射等量的无放射性的促甲状腺激素溶液,向C组注射等量的生理盐水。
第五步:每隔一定时间,分别测定三组兔子甲状腺中碘的放射量,记录并计算平均值。
回答下列问题:
①指出上述实验方法步骤第一步中的两处不严谨之处:__________________________
_________________________________________________。
②如果实验步骤第一步改正后,实施整个实验,请你预测最终实验结果:
A、B、C三组兔子甲状腺中碘的放射量平均值从高到低排列的顺序是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组利用所学知识进行下列实验研究。请回答下列问题:
(1) 利用高锰酸钾分解制氧气,并测定高锰酸钾的质量分数。实验停止加热如图I所示(导管出口高于液面)。
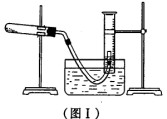
①测量收集到气体体积必须包括的几个步骤:a.调整量筒内外液面高度使之相同;
b.使试管和量筒内的气体都冷却至室温;c.读取量筒内气体的体积。这三步操作的正
确顺序是:___________(请填写步骤代号)。
②测量收集到气体体积时,如何使量筒内外液面的高度相同?____________。
(2) 为了得到二氧化锰,实验完毕将图I中的试管冷却后,把剩余的药品倒入烧
杯中加水溶解,再经过滤、洗涤和干燥得到纯净的二氧化锰。“过滤”中使用的玻璃仪
器是_____________________。
(3) 图Ⅱ是实验室制取TiCl4。的装置。四氯化钛是无色液体,沸点为1360C。它极
易水解,遇空气中的水蒸气即产生“白烟”(TiCl4+H2O=TiOCl2+2HCl↑)。在
6500C~8500C下,将氯气通过二氧化钛和炭粉的混合物可得到四氯化钛和CO气体。
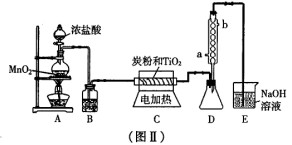
①A装置中反应的离子方程式______________________________
②B装置中的试剂及其作用是______________________________
③D装置中冷凝水的方向为_______________进_______________出。
④请指出此装置的缺陷和不妥之处

查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组利用所学知识进行下列实验研究。请回答下列问题:
(1) 利用高锰酸钾分解制氧气,并测定高锰酸钾的质量分数。实验停止加热如图I所示(导管出口高于液面)。
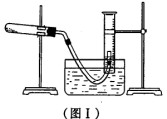
①测量收集到气体体积必须包括的几个步骤:a.调整量筒内外液面高度使之相同;
b.使试管和量筒内的气体都冷却至室温;c.读取量筒内气体的体积。这三步操作的正
确顺序是:___________(请填写步骤代号)。
②测量收集到气体体积时,如何使量筒内外液面的高度相同?____________。
(2) 为了得到二氧化锰,实验完毕将图I中的试管冷却后,把剩余的药品倒入烧
杯中加水溶解,再经过滤、洗涤和干燥得到纯净的二氧化锰。“过滤”中使用的玻璃仪
器是_____________________。
(3) 图Ⅱ是实验室制取TiCl4。的装置。四氯化钛是无色液体,沸点为1360C。它极
易水解,遇空气中的水蒸气即产生“白烟”(TiCl4+H2O=TiOCl2+2HCl↑)。在
6500C~8500C下,将氯气通过二氧化钛和炭粉的混合物可得到四氯化钛和CO气体。

①A装置中反应的离子方程式______________________________
②B装置中的试剂及其作用是______________________________
③D装置中冷凝水的方向为_______________进_______________出。
④请指出此装置的缺陷和不妥之处

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com