
下列反应的离子方程式不正确的是()
A. FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+=4Fe3++2H2O
B. 物质的量相等的溴化亚铁跟氯气反应2Fe2++2Br﹣+2Cl2=2Fe3++Br2+4Cl﹣
C. 向明矾溶液中滴加Ba(OH)2,恰好使SO42﹣沉淀完全:2A13++3SO42﹣+3Ba2++6OH﹣═2A1(OH)3↓+3BaSO4↓
D. 向碳酸钠溶液中滴加过量的稀硫酸:CO32﹣+2H+=CO2↑+H2O
考点: 离子方程式的书写.
专题: 离子反应专题.
分析: A.亚铁离子空气中的氧气易被氧化为铁离子;
B.氯气先氧化亚铁离子;
C.恰好使SO42﹣沉淀完全,明矾与Ba(OH)2的物质的量之比为1:2;
D.可溶性碳酸盐与酸反应的实质为碳酸根离子与氢离子反应生成二氧化碳和水.
解答: 解:A.因亚铁离子空气中的氧气易被氧化为铁离子,则FeSO4酸性溶液暴露在空气中的离子反应为4Fe2++O2+4H+=
4Fe3++2H2O,故A正确;
B.氯气先氧化亚铁离子,等物质的量的溴化亚铁跟氯气反应,由电子守恒可知,亚铁离子全部被氧化,溴离子一半被氧化,则物质的量相等的溴化亚铁跟氯气反应的离子反应方程式为2Fe2++2Br﹣+2Cl2=2Fe3++Br2+4Cl﹣,故B正确;
C.恰好使SO42﹣沉淀完全,明矾与Ba(OH)2的物质的量之比为1:2,则向明矾溶液中滴加Ba(OH)2,恰好使SO42﹣沉淀完全的离子反应为A13++2SO42﹣+2Ba2++4OH﹣═A1O2﹣+2BaSO4↓,故C错误;
D.可溶性碳酸盐与酸反应的实质为碳酸根离子与氢离子反应生成二氧化碳和水,则向碳酸钠溶液中滴加过量的稀硫酸的离子反应为CO32﹣+2H+=CO2↑+H2O,故D正确;
故选C.
点评: 本题考查离子反应方程式书写的正误判断,明确发生的化学反应是解答本题的关键,难度不大,选项B为学生解答的难点.


科目:高中化学 来源: 题型:
下列实验操作或记录正确的是 ( )
A.用托盘天平称取2.50 g胆矾,受热充分失水后,固体质量减轻0.90 g
B.用量筒测得排水法收集制得的氢气体积为50.28 mL
C.用两只250 mL的容量瓶配制0.1 mol·L-1500 mLNaOH溶液
D.常温常压下测得1 mol N2的质量为28 g
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作中正确的是()
A. 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
B. 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C. 分液操作时,先将分液漏斗中下层液体从下口全部放出,再将上层液体从下口放出
D. 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
查看答案和解析>>
科目:高中化学 来源: 题型:
有一包白色粉末,其中可能含有NaNO3、CaCl2、K2CO3.现做以下实验:①将部分粉末加入水中,振荡,有白色沉淀生成;②向①的悬浊液中加入过量稀硝酸,振荡,白色沉淀消失并有气泡产生;③取少量②的溶液滴入AgNO3溶液,有白色沉淀生成.
根据上述实验现象,完成下列各题:
(1)原白色粉末中肯定含有的物质为 ,可能含有的物质为 .
(2)写出步骤①中发生反应的化学方程式 .
(3)写出步骤②中发生反应的离子方程式为 .
(4)写出步骤③中发生反应的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上部分内容.据此下列说法正确的是()

A. 该试剂的物质的量浓度为9.2 mol•L﹣1
B. 该硫酸50 mL与足量的铜反应可得到标准状况下SO2 10.3 L
C. 配制200 mL 4.6 mol•L﹣1的稀硫酸需取该硫酸50 mL
D. 该硫酸与等体积的水混合所得溶液的质量分数小于49%
查看答案和解析>>
科目:高中化学 来源: 题型:
用下面的方案进行某些离子的检验,其中方案设计得最严密的是()
A. 检验试液中的SO42﹣:试液 无沉淀
无沉淀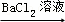 白色沉淀
白色沉淀
B. 检验试液中的Fe2+:试液 无明显现象
无明显现象 红色溶液
红色溶液
C. 检验试液中的I﹣:试液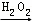 棕黄色溶液
棕黄色溶液 蓝色溶液
蓝色溶液
D. 检验试液中的CO32﹣:试液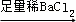 白色沉淀
白色沉淀 沉淀溶解
沉淀溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下的定容密闭容器中,当下列物理量不再变化时,不能表明反应:A(s)+2B(g)⇌C(g)+D(g)已达到平衡状态的是 ()
A. C的物质的量浓度 B. 混合气体的密度
C. 容器内压强 D. 混合气体的平均分子量
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物Ⅰ可以用E和H在一定条件下合成:请根据以下信息完成下列问题:
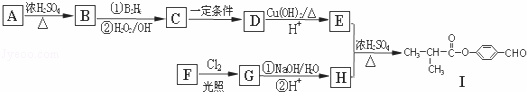
①A为丁醇且核磁共振氢谱有2种不同化学环境的氢
②R﹣CH=CH2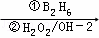 R﹣CH2CH2OH
R﹣CH2CH2OH
③一个碳原子上连有两个羟基不稳定,易脱水形成羰基.
(1)B的分子式为: .
(2)C→D的反应类型为
(3)芳香族化合物F的分子式为C7H8O,苯环上的一氯代物只有两种,则F的结构简式为: .
(4)D生成E的化学方程式为 .E与H反应生成I的方程式为 .
(5)I的同系物K相对分子质量比I小28.K的结构中能同时满足如下条件:①苯环上只有两个取代基;②分子中不含甲基.共有 种(不考虑立体异构).试写出上述同分异构体中任意一种消耗NaOH最多的有机物结构简式 .
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南师大附属中学高二上二次阶段测化学卷(解析版) 题型:选择题
浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg 的变化如图所示,下列叙述错误的是
的变化如图所示,下列叙述错误的是

A.MOH的碱性强于ROH的碱性
B.ROH的电离程度:b点大于a点
C.若两溶液无限稀释,则它们的c(OH-)相等
D.当lg =2时,若两溶液同时升高温度,则
=2时,若两溶液同时升高温度,则 增大
增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com