
下列溶液中的Cl-浓度与50mL 1mol·L-1氯化铝溶液中的Cl-浓度相等的是
A.150mL、1 mol·L-1 氯化钠溶液
B.75mL、2 mol·L-1 氯化铵溶液
C.150mL、1 mol·L-1 氯化钾溶液
D.75mL、1mol·L-1 氯化铝溶液
科目:高中化学 来源:2016-2017学年贵州省高二上期中化学卷(解析版) 题型:选择题
一定条件下,固定容积的密闭容器中,CO和H2反应生成甲醇:CO(g)+2H2(g)  CH3OH(g)。如图是该反应在不同温度下CO的转化率随时间变化的曲线。下列判断正确的是 ( )
CH3OH(g)。如图是该反应在不同温度下CO的转化率随时间变化的曲线。下列判断正确的是 ( )
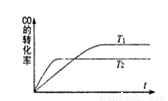
A.T1>T2
B.该反应的△H >0
C.T1时的平衡常数K1> T2时的平衡常数K2
D.T1时的平衡常数K1< T2时的平衡常数K2
查看答案和解析>>
科目:高中化学 来源:2017届安徽省培优联盟高三冬季联赛化学试卷(解析版) 题型:填空题
【化学一选修3:物质结构与性质】
铜也是日常生活中常见的金属,它的单质及化合物在科学研究和工农业生产中具有广泛的用途。请回答以下问題:
(1)超细铜粉可用作导电材料、傕化剂等,制备方法如下:
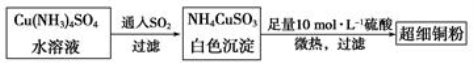
写出基态Cu的外围电子排布式________________,铜元素位于周期表中笫______________族;NH4CuSO3所含元素中第一电离能最大是____________(填元素符号)。
SO42-中心原子的杂化方式为___________,SO32-的空间构型为__________。
③ 将NH4CuSO3溶于足量稀硫酸中,有剌激性气味的气体放出,该气体是__________,所得溶液呈__________色。
(2)某学生向CuSO4浓液中加入少量氨水生成蓝色沉淀,继续加入过量氨水沉淀溶解,得到 深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4 • H2O晶体。
①下列说法正确的是_______(填代号)
A.氨气极易溶于水,是因为NH3和H2O之间形成了极性共价键
B.NH3和H2O中心原子的杂化方式相同,键角也相同
c.Cu(NH3)4SO4所含的化学键有离子键、极性键和配位键
d.[Cu(NH3)4]SO4中配离子的空间构型为正方形
②请解释加入乙醇后析出晶体的原因________________。
(3)Cu晶体的堆积方式如右图所示,设Cu原子半径为a,晶体中Cu原子的配位数为______________,晶体的空间利用率为________________。(已知: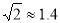 ,列式并计算出结果)
,列式并计算出结果)

查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省分校高一上期中化学卷(解析版) 题型:选择题
 某物质A在一定条件下加热分解,产物都是气体,分解方程式为2A
某物质A在一定条件下加热分解,产物都是气体,分解方程式为2A B+2C+2D。测得生成的混合气体对氢气的相对密度为d,则A的相对分子质量为
B+2C+2D。测得生成的混合气体对氢气的相对密度为d,则A的相对分子质量为
A.7d B.5d C.3d D.2d
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省分校高一上期中化学卷(解析版) 题型:选择题
下列反应的离子方程式中,正确的是
A.铜跟稀硫酸反应:Cu+2H+ Cu2++H2↑
Cu2++H2↑
B.浓盐酸跟氢氧化钾溶液反应:H++OH- H2O
H2O
C.向澄清石灰水中通入少量CO2:OH-+CO2 HCO
HCO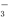
D.碳酸镁跟浓硫酸反应:MgCO3+2H+ Mg2++H2O+CO2↑
Mg2++H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省分校高一上期中化学卷(解析版) 题型:选择题
下列实验基本操作(或注意事项)中,主要是出于实验安全考虑的是
A. 实验剩余的药品不能放回原试剂瓶 B. 可燃性气体的验纯
C. 气体实验装置在实验前进行气密性检查 D. 滴管不能交叉使用
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省分校高二上期中化学卷(解析版) 题型:选择题
室温下,一气态烃与过量氧气混合完全燃烧,恢复到室温,使燃烧产物通过浓硫酸,体积比反应前减少50mL,再通过NaOH溶液,体积又减少了40mL,原烃的分子式是( )
A.CH4 B.C4H10 C.C2H6 D.C3H8
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省分校高二上期中化学卷(解析版) 题型:选择题
既可以用来鉴别乙烷和乙烯,又可以用来除去乙烷中混有的少量乙烯的操作方法是( )
A.用高锰酸钾溶液 
 B.与足量溴水反应
B.与足量溴水反应
C.在一定条件下通入氢气 D.分别进行燃烧
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省大连市高三12月月考化学试卷(解析版) 题型:实验题
Ⅰ.某化学兴趣小组用FeCl2(用铁粉与盐酸反应制得)和NH4HCO3制备FeCO3的装置示意图如图所示。回答下列问题:
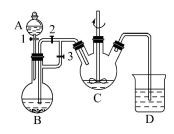
(1)A装置的名称是____________;FeCO3在________中生成(填字母),该装置中发生的主要反应的离子方程式为____________________。
(2)实验时首先打开活塞3,关闭活塞2,其目的是___________________;然后再关闭活塞3,打开活塞2,其目的是_____________________。
Ⅱ.乳酸亚铁晶体([CH3CH(OH)COO]2Fe·3H2O,Mr=288)是常用的补铁剂。乳酸亚铁可由乳酸与碳酸亚铁反应制得。
(3)将制得的FeCO3加入乳酸溶液中,再加入过量铁粉,75℃下搅拌使之充分反应。结束后,无需过滤,除去过量铁粉的反应方程式为_____________。
(4)从上述(3)所得溶液中获得乳酸亚铁晶体的方法是___________________、___________________、洗涤、干燥。
(5)该兴趣小组用KMnO4测定产品中亚铁含量进而计算乳酸亚铁晶体的质量分数,发现产品的质量分数总是大于1 00%,其原因可能是_______________。经查阅文献后,该兴趣小组改用铈(Ce)量法测定产品中Fe2+的含量。取2.880 g产品配成100 mL溶液,每次取20.00 mL,进行必要处理,用0.100 0 mol·L-1Ce(SO4)2标准溶液滴定至终点,平均消耗Ce(SO4)219.7 mL。滴定反应为Ce4++Fe2+====Ce3++Fe3+,则产品中乳酸亚铁晶体的质量分数为____________。
00%,其原因可能是_______________。经查阅文献后,该兴趣小组改用铈(Ce)量法测定产品中Fe2+的含量。取2.880 g产品配成100 mL溶液,每次取20.00 mL,进行必要处理,用0.100 0 mol·L-1Ce(SO4)2标准溶液滴定至终点,平均消耗Ce(SO4)219.7 mL。滴定反应为Ce4++Fe2+====Ce3++Fe3+,则产品中乳酸亚铁晶体的质量分数为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com