
【题目】在密闭容器中一定量混合气体发生反应:2A(g)+B(g)![]() xC(g),达到平衡时测得A的浓度为0.5mol/L,在温度不变的条件下,将容器中的容积扩大到原来2倍,再达平衡时,测得A的浓度为0.3mol/L,下列有关判断正确的是
xC(g),达到平衡时测得A的浓度为0.5mol/L,在温度不变的条件下,将容器中的容积扩大到原来2倍,再达平衡时,测得A的浓度为0.3mol/L,下列有关判断正确的是
A. x=3 B. 平衡向正反应方向移动
C. B的转化率降低 D. C的体积分数增大
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:
【题目】向一容积不变的密闭容器中充入一定量A和B,发生如下反应:xA(g)+yB(s) ![]() zC(g) ΔH<0。反应中A和B消耗的物质的量相同,在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:
zC(g) ΔH<0。反应中A和B消耗的物质的量相同,在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:

(1)根据图示可确定x∶y∶z=__________________________。(用最简整数比表示)
(2)0~10 min容器内压强______________(填“变大”、“不变”或“变小”)。
(3)推测第10 min引起曲线变化的反应条件可能是________;第16 min引起曲线变化的反应条件可能是________。(选填数字编号)
①减压 ②增大A的浓度 ③增大C的量 ④升温 ⑤降温 ⑥加催化剂
(4)平衡Ⅰ的平衡常数为K1=___________,平衡Ⅱ平衡常数为K2,则K1________K2(填“>”、“=”或“<”)。
(5)在平衡I的温度下,假设容积恒定为1L,下列措施中能使平衡时 n(A)/n(C)增大的有___________(选填字母编号)
A.升高温度 B.充入氦气 C.再充入0.2molA和0.5molC D.使用催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器中通入a molX气体并发生反应:2X(g) ![]() Y(g),在T1、T2温度下,X的物质的量n(X)随时间t变化的曲线如图所示。下列叙述不正确的是
Y(g),在T1、T2温度下,X的物质的量n(X)随时间t变化的曲线如图所示。下列叙述不正确的是

A. 正反应方向为放热反应
B. 在T2温度下,在0~t1时间内,v (Y) = ![]() mol(Lmin)-1
mol(Lmin)-1
C. M点的正反应速率v(正)大于N点的逆反应速率v(逆)
D. W点时再加入一定量X,平衡后X的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一包Na2CO3和Na2SO4固体粉末混合物22.2g,向其中加入足量的稀H2SO4 , 产生气体的质量和加入稀H2SO4的质量关系如图所示.
(1)Na2CO3中钠元素与氧元素的质量比为 , 产生气体的质量为g.
(2)恰好完全反应时,求所得稀H2SO4中溶质的质量;
(3)求恰好完全反应是溶液中溶质的质量分数.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种金属A与B和稀硫酸组成原电池时,A是正极。下列有关推断正确的是( )
A. A的金属性强于B
B. 电子不断由A电极经外电路流向B电极
C. A电极上发生的电极反应是还原反应
D. A的金属活动性一定排在氢前面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关。下列说法不正确的是( )
A.除去废水中的Cu2+、Ag+等重金属离子可选用Na2S溶液
B.保存FeCl3溶液时,通常在溶液中加少量的单质铁
C.检查消化系统使用“钡餐”的成分是硫酸钡
D.除去水垢中的CaSO4常用试剂有碳酸钠和盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚铁氰化钾K4[Fe(CN)6],俗名黄血盐,可溶于水,不溶于乙醇。在化学实验、电镀、食品添加剂、烧制青花瓷时可用于绘画等方面有广泛用途。已知HCN是一种极弱的酸,现有一种用含NaCN的废水合成黄血盐的主要工艺流程如下:
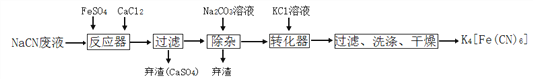
(1)常温下,NaCN水溶液的pH _______ 7(填“>”、“=”、“<”),实验室用NaCN固体配制NaCN溶液时,应先将其溶于_______溶液,再用蒸馏水稀释。
(2)反应器中发生的主要反应的化学方程式为 _____________________________。
(3)流程中加入Na2CO3溶液后过滤除去弃渣,过滤需要的玻璃仪器有烧杯、漏斗、______。
(4)转化器中生成K4[Fe(CN)6]的反应类型是________________,相同温度下,溶解度:K4[Fe(CN)6] _______ Na4[Fe(CN)6](填“>”、“=”、“<”) ,过滤后洗涤K4[Fe(CN)6]使用的试剂是________________。
(5)实验室常用K4[Fe(CN)6]检验Fe3+,生成难溶盐KFe[Fe(CN)6],试写出上述反应的离子方程式为 _________________________。
(6)含有14.7kg NaCN的工业废水可生产出9.2kg的K4[Fe(CN)6],则K4[Fe(CN)6]的产率是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图中a、b、c三种物质的溶解度曲线,回答下列问题:
(1)P点表示在t1℃两物质的溶解度关系为bc(填“>”、“<”或“=”).
(2)t2℃,a、b、c三种物质的饱和溶液溶质质量分数的大小关系为 .
(3)t2℃时,50g b物质加入到50g水中充分溶解后,所得溶液的质量为 .
(4)b中含有少量的a,若要提纯b,可采用结晶的方法.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com