
【题目】根据如图中a、b、c三种物质的溶解度曲线,回答下列问题:
(1)P点表示在t1℃两物质的溶解度关系为bc(填“>”、“<”或“=”).
(2)t2℃,a、b、c三种物质的饱和溶液溶质质量分数的大小关系为 .
(3)t2℃时,50g b物质加入到50g水中充分溶解后,所得溶液的质量为 .
(4)b中含有少量的a,若要提纯b,可采用结晶的方法.
【答案】
(1)=
(2)b>a>c
(3)75g
(4)降温(或冷却热饱和溶液)
【解析】解:(1)曲线中交点表示该温度时两种物质的溶解度相等,所以P点表示在t1℃两物质的溶解度相等;(2)饱和溶液的质量分数: ![]() ×100%,所以与溶解度有关,因为t2℃,a、b、c三种物质的溶解度大小是:b>a>c,所以它们饱和溶液的质量分数也是:b>a>c;(3)t2℃时,b物质的溶解度是50g,即100g水中溶解50g,所以50g水中只能溶解25g,所以所得溶液质量为50g+25g=75g;(4)如果溶解度受温度影响较大的物质从溶液中结晶析出的方法是冷却热饱和溶液,如果溶解度受温度影响不大的物质从溶液中结晶析出的方法是蒸发溶剂.由于b得的溶解度随着温度变化比较大,所以用降温结晶或冷却热饱和溶液的方法析出晶体. 所以答案是:(1)=(2)b>a>c (或c<a<b);(3)75g;(4)降温(或冷却热饱和溶液).
×100%,所以与溶解度有关,因为t2℃,a、b、c三种物质的溶解度大小是:b>a>c,所以它们饱和溶液的质量分数也是:b>a>c;(3)t2℃时,b物质的溶解度是50g,即100g水中溶解50g,所以50g水中只能溶解25g,所以所得溶液质量为50g+25g=75g;(4)如果溶解度受温度影响较大的物质从溶液中结晶析出的方法是冷却热饱和溶液,如果溶解度受温度影响不大的物质从溶液中结晶析出的方法是蒸发溶剂.由于b得的溶解度随着温度变化比较大,所以用降温结晶或冷却热饱和溶液的方法析出晶体. 所以答案是:(1)=(2)b>a>c (或c<a<b);(3)75g;(4)降温(或冷却热饱和溶液).
【考点精析】通过灵活运用结晶的原理、方法及其应用和固体溶解度曲线及其作用,掌握结晶的两种方法:蒸发溶剂,如NaCl(海水晒盐)和降低温度(冷却热的饱和溶液,如KNO3);1.查找指定温度时物质的溶解度,并根据溶解度判断溶解性.2.比较相同温度时(或一定温度范围内)不同物质溶解度的大小.3.比较和确定物质的溶解度受温度影响的程度,并据此确定物质结晶或混合物分离提纯的方法.4.确定溶液的状态(饱和与不饱和)即可以解答此题.


科目:高中化学 来源: 题型:
【题目】在密闭容器中一定量混合气体发生反应:2A(g)+B(g)![]() xC(g),达到平衡时测得A的浓度为0.5mol/L,在温度不变的条件下,将容器中的容积扩大到原来2倍,再达平衡时,测得A的浓度为0.3mol/L,下列有关判断正确的是
xC(g),达到平衡时测得A的浓度为0.5mol/L,在温度不变的条件下,将容器中的容积扩大到原来2倍,再达平衡时,测得A的浓度为0.3mol/L,下列有关判断正确的是
A. x=3 B. 平衡向正反应方向移动
C. B的转化率降低 D. C的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于SO2的叙述正确的是( )
A.SO2是具有漂白作用,可使石蕊褪色B.SO2与NaOH溶液反应生成Na2SO4
C.SO2能使溴水褪色,是因为SO2具有还原性D.SO2有毒,不能用作食品添加剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Na2O2可用作漂白剂和呼吸面具中的供氧剂.
(1)写出Na2O2作供氧剂的反应方程式________________________________________。
(2)Na2O2有强氧化性,H2具有还原性,有同学猜想Na2O2与H2能反应。为了验证此猜想,该小组同学进行如下实验,实验步骤和现象如下。
步骤1:按图组装仪器(图中夹持仪器省略),检查气密性,装入药品;

步骤2:打开K1、K2,产生的氢气流经装有Na2O2的硬质玻璃管,一段时间后,没有任何现象;
步骤3:……,开始加热,观察到硬质玻璃管内Na2O2开始熔化,淡黄色的粉末变成了白色固体,干燥管内硫酸铜未变蓝色;
步骤4:反应后撤去酒精灯,待硬质玻璃管冷却后关闭K1。
①盛装稀盐酸的仪器名称_________;B装置的作用是___________________________。
②步骤3在点燃C处酒精灯前必须进行的操作是________________。
③设置装置D的目的是_______________________。
④根据实验现象你得到的结论是______________________________(用化学方程式表示)。
⑤该实验设计中存在着明显不足之处,应该如何改进:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 一切物质中都存在化学键
B. 含有共价键的物质是共价化合物
C. 由非金属元素组成的化合物是共价化合物
D. 两个非金属元素原子间不可能形成离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种以黄铜矿和硫磺为原料制取钢和其他产物的新工艺,原料的综合利用率较高。其主要流程如下:
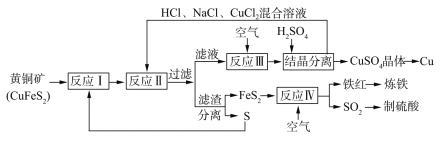
已知:“反应Ⅱ”的离子方程式为Cu2++CuS+4Cl-=2[CuCl2]-+S
回答下列问题:
(1)铁红的化学式为________;
(2)“反应Ⅱ”的还原剂是________(填化学式);
(3)除CuS外“反应II”的产物还有_________(填化学式);
(4)“反应Ⅲ”的离子方程式为_________;
(5)某同学设想利用电化学原理实现以CuSO4、SO2为原料制备Cu和H2SO4,并吸收炼铁过程中产生的CO尾气,实现资源与能源的综合利用。该同学据此组装出的装置如下图所示:

闭合该装置中的K,A池中通入SO2的Pt电极的电极反应式为__________,B池中生成的气体X的电子式为________,若在C池中生成64gCu,则整个装置中共生成H2SO4_____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列十种物质:①Na2O ②Cu(OH)2 ③Zn ④CaCO3 ⑤硫酸溶液 ⑥Ba(OH)2 ⑦干冰 ⑧A12(SO4)3 ⑨HCl水溶液 ⑩KHSO4
(1)其中属于非电解质的有_____________(填序号)。
(2)往②中加入过量的0.1 mol/L⑩的水溶液,发生反应的离子方程式是___________,向所得溶液中继续加入③,会产生无色气泡,该反应的离子方程式是_____________________。
(3)焊接铜器时,可先用NH4Cl除去其表面的氧化铜再进行焊接,该反应可表示为:4CuO+2NH4Cl![]() 3Cu+CuCl2+N2↑+4H2O
3Cu+CuCl2+N2↑+4H2O
①用双线桥标明电子转移的方向和数目。______________________ 。
②该反应中,被氧化的元素是 ,氧化剂是__________________。
③还原剂与氧化产物的物质的量之比为_________________。
④反应中若产生0.2 mol的氮气,则有_______________mol的电子转移。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,m g气体A与n g气体B的分子数目一样多,下列说法不正确的是( )
A. 在任意条件下,若两种分子保持原组成,则其相对分子质量之比为m∶n
B. 25 ℃、1.25×105 Pa时,两气体的密度之比为n∶m
C. 同质量的A、B在非标准状况下,其分子数之比为n∶m
D. 相同状况下,同体积的气体A与B的质量之比为m∶n
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com