
【题目】0.10mol/LCH3COOH溶液中存在如下电离平衡:CH3COOH![]() CH3COO-+H+,对于该平衡,下列叙述正确的是( )
CH3COO-+H+,对于该平衡,下列叙述正确的是( )
A. 加入水时,平衡向逆向移动
B. 加入少量NaOH固体,平衡向正向移动
C. 加入少量0.10mol/LHCl溶液,溶液中C(H+)减少
D. 加入少量CH3COONa固体,平衡向正向移动
科目:高中化学 来源: 题型:
【题目】请完成下列物质的分离提纯问题。
Ⅰ.现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂除去溶液中的NaCl和Na2SO4,从而得到纯净的NaNO3溶液。相应的实验过程可用下图表示:

请回答下列问题:
(1)写出实验流程中下列物质的化学式:试剂X_______。
(2)证明AgNO3溶液加过量的实验方是_____________________________________________ 。(3)按此实验方案得到的溶液3中肯定含有__________(填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的___________(填化学式),之后若要获得固体NaNO3需进行的实验操作是___________(填操作名称)。
Ⅱ.某同学欲用CCl4萃取较高浓度的碘水中的碘,操作过程可以分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把50ml碘水和15mlCCl4加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口的玻璃塞是否漏液;
D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正
E.旋开活塞,用烧杯接收溶液;
F.从分液漏斗上口倒出上层液体;
G.将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准;
H.静置、分层。
(1)萃取过程正确操作步骤的顺序是:_________________________________ (填编号字母)。
(2)从含碘的CCl4溶液中提取碘 和回收CCl4,还需要经过蒸馏,观察下图所示实验装置指出其错误有______ 处。
(3)进行上述蒸馏操作时,最后晶态碘在____________(填仪器名称)里聚集。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH>0,测得c(CH4)随反应时间(t)的变化如图所示。下列判断正确的是
CO(g)+3H2(g) ΔH>0,测得c(CH4)随反应时间(t)的变化如图所示。下列判断正确的是

A. 0~5 min内,v(H2)=0.1 mol·(L·min)-1
B. 反应进行到12min时,CH4的转化率为25%
C. 恒温下,缩小容器体积,平衡后H2浓度减小
D. 10 min时,改变的外界条件可能是升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. Na与水反应:Na+H2O=Na++OH-+H2↑
B. 明矾净水原理:Al3++3H2O= Al(OH)3↓+3H+
C. 实验室盛装NaOH溶液的试剂瓶不能用玻璃塞的原因:SiO2+2OH-=SiO32-+H2O
D. Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+= Fe 3++3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁的电化学腐蚀原理如图所示,下列有关说法中错误的是( )
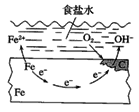
A. 铁片里的铁和碳与食盐水形成无数的微小原电池
B. 铁电极发生氧化反应
C. 负极的电极反应方程式为O2+4e-+2H2O=4OH-
D. 放置一段时间后,铁片上有铁锈出现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S是严重危害环境的气体,采取多种方法减少H2S的排放并加以资源利用。
(1) 用Fe2(SO4)3吸收H2S。在配制硫酸铁溶液时需要向溶液中加入一定量的硫酸,其目的是:________________。吸收时发生反应的离子方程式为_____________________。反应后的溶液在硫杆菌作用下进行再生,反应为:4FeSO4+O2+2H2SO4==2Fe2(SO4)3+2H2O。
图1、图2为再生时Fe2+的转化速率与反应条件的关系。再生的最佳条件为_______________。若反应温度过高,反应速率下降,其原因是_____________________。

(2) 在一定条件下,用H2O2氧化H2S。
随着参加反应的n(H2O2)/n(H2S)变化,氧化产物不同。当n(H2O2)/n(H2S)=4时,氧化产物的化学式为________________。
(3) H2S与CO2在高温下反应可生成氧硫化碳(COS),其结构式为________________。
(4)加热条件下用O2氧化H2S,使硫元素转化为硫单质并回收,写出氧气氧化硫化氢的反应方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的氢气在一定条件下完全燃烧生成气态水,放出热量值为Q1,等量的H2在同样条件下完全燃烧生成液态水,放出热量值为Q2,则Q1与Q2的关系为
A. Q1>Q2 B. Q1=Q2 C. Q1<Q2 D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在“H2A-HA--A2-”的水溶液体系中,H2A、HA-和A2-三者中各自所占的物质的量分数(α)随溶液pH变化的关系如图所示。下列说法不正确的是( )

A. Ka1(H2A)=10-2、Ka2(H2A)=10-5
B. pH=6时,c(HA-)∶c(A2-)=1∶10
C. NaHA溶液中,HA-的水解能力小于HA-的电离能力
D. 在含H2A、HA-和A2-的溶液中,若c(H2A)+2c(A2-)+c(OH-)=c(H+),则α(H2A)和α(HA-)一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学气敏传感器可用于检测环境中NH3的含量,其工作原理示意图如下。

下列说法不正确的是
A. O2在电极b上发生还原反应
B. 溶液中OH+向电极a移动
C. 负极的电极反应式为:2NH3-6e-+6OH-=N2+6H2O
D. 反应消耗的NH3与O2的物质的量之比为4:5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com