
【题目】平板电视显示屏生产过程中产生大量的废玻璃粉末![]() 含
含![]() 、
、![]() 、
、![]() 、FeO等物质
、FeO等物质![]() 某课题小组以此粉末为原料,设计如图1工艺流程对资源进行回收,得到
某课题小组以此粉末为原料,设计如图1工艺流程对资源进行回收,得到![]() 和硫酸铁铵矾:
和硫酸铁铵矾:

已知:
Ⅰ![]() 酸性条件下,铈在水溶液中有
酸性条件下,铈在水溶液中有![]() 、
、![]() 两种主要存在形式,
两种主要存在形式,![]() 易水解,
易水解,![]() 有较强氧化性;
有较强氧化性;
Ⅱ![]() 不溶于稀硫酸;
不溶于稀硫酸;
Ⅲ![]() 硫酸铁铵矾
硫酸铁铵矾![]() 广泛用于水的净化处理.
广泛用于水的净化处理.
![]() 滤液A的主要成分______
滤液A的主要成分______![]() 填写化学式
填写化学式![]() .
.
![]() 写出反应
写出反应![]() 的离子方程式______.
的离子方程式______.
![]() 反应
反应![]() 之前要洗涤滤渣B,对滤渣B进行洗涤的实验操作方法是______
之前要洗涤滤渣B,对滤渣B进行洗涤的实验操作方法是______
![]() 稀土元素的提纯,还可采用萃取法.已知化合物HT作为萃取剂能将铈离子从水溶液中萃取出来,过程表示为
稀土元素的提纯,还可采用萃取法.已知化合物HT作为萃取剂能将铈离子从水溶液中萃取出来,过程表示为![]() 水层
水层![]() 有机层
有机层![]() 有机层
有机层![]() 水层
水层![]() ,分液得到
,分液得到![]() 有机层
有机层![]() ,再加入
,再加入![]() 获得较纯的含
获得较纯的含![]() 的水溶液.可选择硫酸作反萃取剂的原因是______.
的水溶液.可选择硫酸作反萃取剂的原因是______.
![]() 用滴定法测定制得的
用滴定法测定制得的![]() 产品纯度.
产品纯度.

所用![]() 溶液在空气中露置一段时间后再进行滴定,则测得该
溶液在空气中露置一段时间后再进行滴定,则测得该![]() 产品的质量分数______
产品的质量分数______![]() 填“偏大”、“偏小”或“无影响”
填“偏大”、“偏小”或“无影响”![]()
![]() 已知
已知![]() 沉淀的pH范围:
沉淀的pH范围:![]() ,
,![]() 沉淀的pH范围:
沉淀的pH范围:![]() ,
,![]() 沉淀的pH范围:
沉淀的pH范围:![]() ,
,![]() 时
时![]() 能溶于NaOH溶液生成
能溶于NaOH溶液生成![]() 现用
现用![]() 溶液
溶液![]() 含有
含有![]() 杂质
杂质![]() 来制备硫酸铁铵矾.实验中可选用的试剂:
来制备硫酸铁铵矾.实验中可选用的试剂:![]() 溶液、
溶液、![]() 、NaOH溶液、饱和石灰水、稀
、NaOH溶液、饱和石灰水、稀![]() 溶液、稀盐酸.
溶液、稀盐酸.
实验步骤依次为:
![]() 向含有
向含有![]() 杂质的
杂质的![]() 溶液中,加入足量的NaOH溶液至
溶液中,加入足量的NaOH溶液至![]() ,______;
,______;
![]() ______;
______;
![]() 向
向![]() 中得到的溶液中加入硫酸铵溶液,______、______过滤、洗涤、常温晾干,得硫酸铁铵晶体
中得到的溶液中加入硫酸铵溶液,______、______过滤、洗涤、常温晾干,得硫酸铁铵晶体![]()
【答案】![]()
![]() 沿玻璃棒向漏斗中加蒸馏水至没过沉淀,待水自然流下,重复
沿玻璃棒向漏斗中加蒸馏水至没过沉淀,待水自然流下,重复![]() 次 加入硫酸,可使平衡向左进行,使
次 加入硫酸,可使平衡向左进行,使![]() 进入水层 偏大 过滤、洗涤 将沉淀溶解在足量的稀硫酸中,并加入适量
进入水层 偏大 过滤、洗涤 将沉淀溶解在足量的稀硫酸中,并加入适量![]() 溶液,充分反应 蒸发浓缩 冷却结晶
溶液,充分反应 蒸发浓缩 冷却结晶
【解析】
废玻璃粉末![]() 含
含![]() 、
、![]() 、
、![]() 、FeO等物质
、FeO等物质![]() 加入NaOH溶液,
加入NaOH溶液,![]() 和NaOH溶液反应生成硅酸钠,
和NaOH溶液反应生成硅酸钠,![]() 、
、![]() 、FeO不反应,然后过滤,滤液A中含有硅酸钠和NaOH,滤渣A中含有
、FeO不反应,然后过滤,滤液A中含有硅酸钠和NaOH,滤渣A中含有![]() 、
、![]() 、FeO; 向滤渣中加入稀硫酸,
、FeO; 向滤渣中加入稀硫酸,![]() 、FeO溶解生成
、FeO溶解生成![]() 、
、![]() ,
,![]() 不溶于稀硫酸,然后过滤,滤液B中含有
不溶于稀硫酸,然后过滤,滤液B中含有![]() 、
、![]() 和硫酸,滤渣B中含有
和硫酸,滤渣B中含有![]() ;
;
将滤液B氧化得到硫酸铁,然后加热蒸发并加入硫酸铵,通过蒸发浓缩、冷却结晶得到硫酸铁铵钒; 将滤渣B加入稀硫酸和双氧水,![]() 有较强氧化性,能将双氧水氧化为氧气,自身被还原得到
有较强氧化性,能将双氧水氧化为氧气,自身被还原得到![]() ,向溶液中加入碱得到
,向溶液中加入碱得到![]() 悬浊液,将
悬浊液,将![]() 氧化得到
氧化得到![]() 。
。
![]() 根据以上分析,只有二氧化硅能溶于NaOH溶液,所以滤液A的主要成分为
根据以上分析,只有二氧化硅能溶于NaOH溶液,所以滤液A的主要成分为![]() ,故答案为:
,故答案为:![]() ;
;
![]() 反应
反应![]() 为
为![]() 和
和![]() 的氧化还原反应,双氧水被氧化生成氧气,离子反应方程式为
的氧化还原反应,双氧水被氧化生成氧气,离子反应方程式为![]()
![]() ,
,
故答案为:![]()
![]() ;
;
![]() 洗涤沉淀的方法是:沿玻璃棒向漏斗中加蒸馏水至没过沉淀,待水自然流下,重复
洗涤沉淀的方法是:沿玻璃棒向漏斗中加蒸馏水至没过沉淀,待水自然流下,重复![]() 次,从而得到较纯净的沉淀沿玻璃棒向漏斗中加蒸馏水至没过沉淀,待水自然流下,重复
次,从而得到较纯净的沉淀沿玻璃棒向漏斗中加蒸馏水至没过沉淀,待水自然流下,重复![]() 次,故答案为:沿玻璃棒向漏斗中加蒸馏水至没过沉淀,待水自然流下,重复
次,故答案为:沿玻璃棒向漏斗中加蒸馏水至没过沉淀,待水自然流下,重复![]() 次;
次;
![]() 加入硫酸,可使平衡向左进行,使
加入硫酸,可使平衡向左进行,使![]() 进入水层,所以可选择硫酸作反萃取剂,故答案为:加入硫酸,可使平衡向左进行,使
进入水层,所以可选择硫酸作反萃取剂,故答案为:加入硫酸,可使平衡向左进行,使![]() 进入水层;
进入水层;
![]() 所用
所用![]() 溶液在空气中露置一段时间后再进行滴定,部分亚铁离子被氧化生成铁离子,则硫酸亚铁浓度降低,导致硫酸亚铁溶液体积增大,所以测得该
溶液在空气中露置一段时间后再进行滴定,部分亚铁离子被氧化生成铁离子,则硫酸亚铁浓度降低,导致硫酸亚铁溶液体积增大,所以测得该![]() 产品的质量分数偏大,故答案为:偏大;
产品的质量分数偏大,故答案为:偏大;
![]() 分离难溶性固体和溶液采用过滤方法,将沉淀洗涤得到较纯净的物质,亚铁离子和氢氧根离子反应生成沉淀,锌离子和过量氢氧根离子生成偏锌酸根离子,然后采用过滤方法分离,故答案为:过滤;洗涤;
分离难溶性固体和溶液采用过滤方法,将沉淀洗涤得到较纯净的物质,亚铁离子和氢氧根离子反应生成沉淀,锌离子和过量氢氧根离子生成偏锌酸根离子,然后采用过滤方法分离,故答案为:过滤;洗涤;
![]() 硫酸铁和硫酸铵混合得到硫酸铁铵钒,所以将沉淀溶解在足量的稀硫酸中,并加入适量
硫酸铁和硫酸铵混合得到硫酸铁铵钒,所以将沉淀溶解在足量的稀硫酸中,并加入适量![]() 溶液,充分反应得到硫酸铁溶液,故答案为:将沉淀溶解在足量的稀硫酸中,并加入适量
溶液,充分反应得到硫酸铁溶液,故答案为:将沉淀溶解在足量的稀硫酸中,并加入适量![]() 溶液,充分反应;
溶液,充分反应;
![]() 向
向![]() 中得到的溶液中加入硫酸铵溶液,从溶液中获取晶体采用蒸发浓缩、冷却结晶、过滤、洗涤、常温晾干的方法,从而得到晶体,故答案为:蒸发浓缩;冷却结晶。
中得到的溶液中加入硫酸铵溶液,从溶液中获取晶体采用蒸发浓缩、冷却结晶、过滤、洗涤、常温晾干的方法,从而得到晶体,故答案为:蒸发浓缩;冷却结晶。


科目:高中化学 来源: 题型:
【题目】工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示:
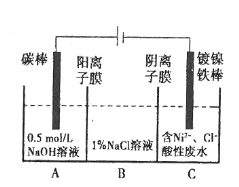
已知:①Ni2+在弱酸性溶液中发生水解②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)。下列说法不正确的是
A.碳棒上发生的电极反应:4OH-—4e-=O2↑+2H2O
B.为了提高Ni的产率,电解过程中需要控制废水pH
C.电解过程中,B中NaCl溶液的物质的量浓度将不断减少
D.若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在20 mL 0.1 mol·L-1一元弱酸HA溶液中滴加0. 1 mol· L-1 NaOH溶液,溶液中1g[c(A-)/c(HA)]与pH关系如图所示。下列说法正确的是

A. A点对应溶液中:c(Na+)>c(A-)>c(H+)>c(OH-)
B. 25℃时,HA酸的电离常数为1. 0× 10-5.3
C. B点对应的NaOH溶液体积为10 mL
D. 对C点溶液加热(不考虑挥发),则c(A-)/[c(HA)c(OH-)]一定增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机反应方程式书写正确的是( )
A.甲烷与氯气的取代反应:CH4+Cl2![]() CH2Cl2+H2
CH2Cl2+H2
B.乙酸与乙醇的酯化反应:CH3COOH+CH3CH2OH![]() CH3COOCH2CH3
CH3COOCH2CH3
C.乙醇的催化氧化反应:CH3CH2OH+O2![]() CH3CHO+H2O
CH3CHO+H2O
D.苯与硝酸的硝化反应:![]() +HNO3
+HNO3![]()
![]() +H2O
+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列图像的叙述正确的是

A.图I表示:反应I2(g)+H2(g) ![]() 2HI(g) ΔH<0发热v-t关系,其中t1时刻改变的条件为升高温度
2HI(g) ΔH<0发热v-t关系,其中t1时刻改变的条件为升高温度
B.图Ⅱ表示:25℃时,用醋酸溶液滴定40.00 mL 0.1000 mol·L-1NaOH溶液的滴定曲线,其中c(CH3COOH)=0.1000mol/L
C.图Ⅲ表示:反应2NO2(g) ![]() N2O4(g)的平衡体系中,N2O4的百分含量与温度(T)、压强(P)的变化关系,其中△H<0、P1<P2
N2O4(g)的平衡体系中,N2O4的百分含量与温度(T)、压强(P)的变化关系,其中△H<0、P1<P2
D.图Ⅳ表示:25℃时,分别稀释等体积,等pH的NaOH溶液与氨水时的pH变化,其中曲线a对应氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质一定属于同系物的是( )
①![]() ②
②![]() ③
③![]() ④C2H4 ⑤CH2=CH-CH=CH2 ⑥C3H6 ⑦
④C2H4 ⑤CH2=CH-CH=CH2 ⑥C3H6 ⑦![]() ⑧
⑧![]()
A.④和⑧B.①、②和③C.⑤、⑦和⑧D.⑥和⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH3—CH=CH2+HBr―→CH3—CHBr—CH3(主要产物)。1 mol某烃A充分燃烧后可以得到8molCO2和4mol H2O。该烃A在不同条件下能发生如图所示的一系列变化。下列说法正确的是( )
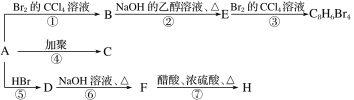
A.A的结构简式C8H10
B.C的结构简式![]()
C.D→F的反应类型是消去反应
D.B→E反应的化学方程式:![]() +NaOH
+NaOH![]()
![]() +NaBr
+NaBr
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是![]()
A.已知![]()
![]() ,则含
,则含![]() gNaOH的稀溶液与稀醋酸完全中和,放出的热量小于
gNaOH的稀溶液与稀醋酸完全中和,放出的热量小于![]()
B.已知![]()
![]() ,则标况下1mol氢气完全燃烧放出
,则标况下1mol氢气完全燃烧放出![]() kJ的热量
kJ的热量
C.已知![]()
![]() ,
,![]()
![]() ,则
,则![]()
D.已知P![]() 白磷,
白磷,![]()
![]() 红磷,
红磷,![]() ,则白磷比红磷稳定
,则白磷比红磷稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2Cl2)是一种重要的化工原料,常用作橡胶硫化剂,改变生橡胶受热发粘、遇冷变硬的性质。查阅资料可知S2Cl2具有下列性质:
物理性质 | 毒性 | 色态 | 挥发性 | 熔点 | 沸点 |
剧毒 | 金黄色液体 | 易挥发 | -76℃ | 138℃ | |
化学性质 | ①300℃以上完全分解; ②S2Cl2+Cl2 ③遇高热或与明火接触,有引起燃烧的危险; ④受热或遇水分解放热,放出腐蚀性烟气; | ||||
(1)制取少量S2Cl2
实验室可利用硫与少量氯气在110~140℃反应制得S2Cl2粗品。
①仪器m的名称为___,装置F中试剂的作用是___。
②装置连接顺序:A→___→E→D。
③实验前打开K1,通入一段时间的氮气排尽装置内空气。实验结束停止加热后,再通入一段时间的氮气,其目的是___。
④为了提高S2Cl2的纯度,实验的关键是控制好温度和___。
(2)①S2Cl2遇水强烈反应产生烟雾,其产物中有一种气体X能使品红溶液褪色,加热后又恢复原状,且反应过程中只有一种元素化合价发生变化,写出该反应的化学方程式___。
②甲同学为了验证两种气体产物,将水解生成的气体依次通过硝酸银与稀硝酸的混合溶液、品红溶液、NaOH 溶液,该方案___(填“可行”或“不可行”),原因是___。
(3)某同学为了测定S2Cl2与水反应后生成的气体X在混合气体中的体积分数,设计了如下实验方案:

①W溶液可以是___(填标号)。
a.H2O2溶液 b.KMnO4溶液(硫酸酸化) c.氯水
②该混合气体中气体X的体积分数为____(用含V、m的式子表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com