
| A. | 随着核电荷数增加,碱金属单质的密度逐渐增大 | |
| B. | 随着核电荷数增加,卤素单质的熔沸点逐渐降低 | |
| C. | 随着核电荷数的增加,碱金属单质与水反应的剧烈程度增大 | |
| D. | 随着核电荷数增加,碱金属离子的氧化性逐渐增强,卤素离子的还原性逐渐减弱 |
分析 A.碱金属中Na的密度大于K的密度;
B.卤素单质为分子晶体,相对分子质量大的熔沸点大;
C.随着核电荷数的增加,碱金属单质还原性增强;
D.随着核电荷数的增加,碱金属单质还原性增强,对应离子的氧化性减弱,而卤素离子还原性增强.
解答 解:A.碱金属中Na的密度大于K的密度,则随着核电荷数增加,碱金属单质的密度呈增大趋势,故A错误;
B.卤素单质为分子晶体,相对分子质量大的熔沸点大,则随着核电荷数增加,卤素单质的熔沸点逐渐增大,故B错误;
C.随着核电荷数的增加,碱金属单质还原性增强,则碱金属单质与水反应的剧烈程度增大,故C正确;
D.随着核电荷数的增加,碱金属单质还原性增强,对应离子的氧化性减弱,而卤素随着核电荷数增加非金属性减弱,卤素离子还原性增强,故D错误;
故选C.
点评 本题考查元素周期表和周期律的应用,为高频考点,把握元素的位置、性质及元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:选择题
| 假设 | 推断 | |
| A | 若X、Y均能发生消去反应 | Z一定能发生消去反应 |
| B | 若X是白酒的主要成分 | Y可能是丙三醇 |
| C | 若X、Y分子中分别有1个、2个碳原子 | Z的摩尔质量不小于60 g•mol-1 |
| D | 若X、Y均存在醇类同分异构体 | Z一定存在醇类同分异构体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
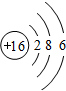 ,G元素形成的单质的结构式为Cl-Cl.
,G元素形成的单质的结构式为Cl-Cl. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH2+H2→CH3-CH3 | B. | CH2=CH2+3O2→2CO2+2H2O | ||
| C. | CH2=CH2+Br2→CH2Br-CH2Br | D. | CH2=CH2+H2O$\frac{\underline{\;催化剂\;}}{\;}$CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯和浓溴水混合加入铁作催化剂制溴苯 | |
| B. | 将苯和浓硝酸混合共热制硝基苯 | |
| C. | 可用分液漏斗分离硝基苯和水 | |
| D. | 乙烯通入溴的四氯化碳溶液中获得1,1-二溴乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
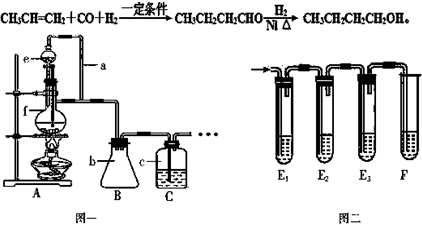

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图中,AB段的反应为Fe+2Fe 3+=3Fe 2+,溶液中溶质最终为FeSO 4 | |
| B. | 原溶液中H2SO4浓度为2.5mol•L -1 | |
| C. | 原混合溶液中NO3-的物质的量为0.4mol | |
| D. | 图中,OA段产生的气体是NO,BC段产生的气体是氢气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com