
【题目】一定条件下的密闭容器中:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH=-905.9 kJ/mol,下列叙述正确的是( )
4NO(g)+6H2O(g) ΔH=-905.9 kJ/mol,下列叙述正确的是( )
A. 4 mol NH3和5 mol O2反应,达到平衡时放出的热量为905.9 kJ
B. 平衡时5v正(O2)= 4v逆(NO)
C. 平衡后增大压强,混合气体的平均摩尔质量增大
D. 平衡后升高温度,混合气体中NO含量增大
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】醋酸亚铬[(CH3COO)2Cr·H2O]为砖红色晶体,难溶于冷水,易溶于酸,在气体分析中用作氧气吸收剂。一般制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价铬;二价铬再与醋酸钠溶液作用即可制得醋酸亚铬。实验装置如图所示,回答下列问题:

(1)实验中所用蒸馏水均需经煮沸后迅速冷却,目的是_________,仪器a的名称是_______。
(2)将过量锌粒和氯化铬固体置于c中,加入少量蒸馏水,按图连接好装置,打开K1、K2,关闭K3。
①c中溶液由绿色逐渐变为亮蓝色,该反应的离子方程式为_________。
②同时c中有气体产生,该气体的作用是_____________。
(3)打开K3,关闭K1和K2。c中亮蓝色溶液流入d,其原因是________;d中析出砖红色沉淀,为使沉淀充分析出并分离,需采用的操作是___________、_________、洗涤、干燥。
(4)指出装置d可能存在的缺点______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某温度时,将n mol/L的氨水滴入10 mL1.0 mol/L盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示,下列有关说法正确的是

A. a点KW=1.0×10-14
B. 水的电离程度:b﹥a﹥c﹥d
C. b点:c(NH4+)﹥c(Cl-)﹥c(H+)﹥c(OH-)
D. 25℃时NH4Cl水解平衡常数为(n-1)×10-7(用n表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)甲醛的电子式:____________________。
(2)2,5-二甲基-2,4-己二烯的结构简式______________________________。
(3)![]() 的键线式为________________________。
的键线式为________________________。
(4)写出分子式为C4H9Cl的所有同分异构体中核磁共振氢谱只有一组峰的结构简式_______________。
(5)![]() 中含氧官能团的名称是______________________。
中含氧官能团的名称是______________________。
(6)用系统命名法命名下列有机物:
①![]() ______________________。
______________________。
②![]() ______________________。
______________________。
③![]() ______________________。
______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种Cu-Li可充电电池的工作原理如图所示,其中非水系电解液和水系电解液被锂离子固体电解质陶瓷片(LISICON)隔开。下列说法正确的是
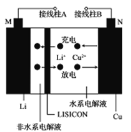
A. 陶瓷片允许水分子通过
B. 电池放电时,N极上发生氧化反应
C. 电池充电时,接线柱B应与外接直流电源的正极相连
D. 电池充电时,阳极反应为Li++e-=Li
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填写下列空白:
(1)写出表示含有8个质子、10个中子的原子的化学符号:__________。
(2)周期表中最活泼的非金属元素位于第__________纵行。
(3)周期表中位于第4周期、ⅡA族的元素符号是:___________ 。
(4)所含元素为18种的周期是第_________周期、第________周期。
(5)写出第2周期、ⅤA族元素单质的电子式:______________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L密闭容器中,800 ℃时,反应2NO+O2![]() 2NO2体系中,n(NO)随时间的变化如下表:
2NO2体系中,n(NO)随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)如图表示各物质浓度的变化曲线,
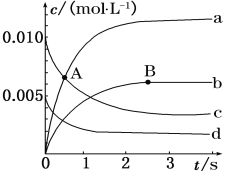
A点处,v(正)___________v(逆), A点正反应速率_________B点正反应速率。 (用“大于”、“小于”或“等于”填空)
(2)图中表示O2变化的曲线是___________。用NO2表示从0~2 s内该反应的平均速率v=____________________________。
(3) 能使该反应的反应速率增大的是____________。
A.及时分离出NO2气体 B.升高温度
C.减小O2的浓度 D.选择高效的催化剂
(4) 能说明该反应已经达到平衡状态的是___________。
A.容器内压强保持不变 B.v(NO)=2v(O2)
C.容器内的密度保持不变 D.v逆(NO2)=2v正(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示A处通入潮湿的Cl2,关闭活塞B时D中干燥的红色布条颜色无变化;打开活塞B时D处干燥的红色布条褪色,则C中的试剂(足量)不可能是
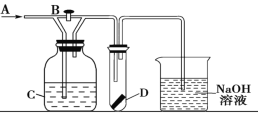
A.饱和氯化钠溶液B.氢氧化钙悬浊液C.饱和碳酸钠溶液D.浓硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
(1)原子半径最小的元素是____(填元素名称),写出⑧的原子结构示意图______。
(2)最高价氧化物对应的水化物中,碱性最强的是___(用化学式回答,下同),酸性最强的是___。
(3)①与⑤形成的化合物中,化学键类型为_____。
(4)⑦与⑨形成的化合物的电子式为___,②与④形成的原子个数比为1:2的化合物的结构式为____。
(5)③、④、⑥的原子半径由大到小的顺序为_____(用元素符号回答)。
(6)为探究元素②和⑧的非金属性强弱,某同学设计了如图所示的装置进行实验(夹持仪器已略去,装置气密性良好)。请回答:
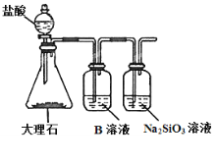
a.溶液B的作用是_______
b.若看到____现象,即可证明酸性_______(用化学式回答),则非金属性_______(用元素符号回答)。
c.上述实验中,能说明②和⑧非金属性强弱的化学方程式是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com