
【题目】一种Cu-Li可充电电池的工作原理如图所示,其中非水系电解液和水系电解液被锂离子固体电解质陶瓷片(LISICON)隔开。下列说法正确的是
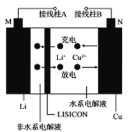
A. 陶瓷片允许水分子通过
B. 电池放电时,N极上发生氧化反应
C. 电池充电时,接线柱B应与外接直流电源的正极相连
D. 电池充电时,阳极反应为Li++e-=Li
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知A(g)+C(g)===D(g);ΔH=-Q1kJ/mol,B(g)+C(g)===E(g);ΔH=-Q2kJ/mol,Q1、Q2均大于0,且Q1>Q2,若A与B组成的混合气体 1mol与足量的C反应,放热为Q3kJ,则原混合气体中A与B物质的量之比为( )
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能够表示燃烧热的是( )
A. 2H2(g)+O2(g)=2H2O(g);△H1
B. S(g)+O2(g)= SO2(g);△H2
C. C(s)+![]() O2(g)= CO(g);△H3
O2(g)= CO(g);△H3
D. H2(g)+Cl2(g) = 2HCl(g);△H4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于各图的说法中正确的是
A.  ①中阳极处能产生使湿润淀粉-KI试纸变蓝的气体
①中阳极处能产生使湿润淀粉-KI试纸变蓝的气体
B.  ②中待镀铁制品应与电源正极相连
②中待镀铁制品应与电源正极相连
C.  ③中钢闸门应与外接电源的负极相连,称为牺牲阳极的阴极保护法
③中钢闸门应与外接电源的负极相连,称为牺牲阳极的阴极保护法
D.  ④中离子交换膜可以避免生成的Cl2与NaOH溶液反应
④中离子交换膜可以避免生成的Cl2与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.由于亚硝酸钠和食盐性状相似,曾多次发生过将NaNO2误当食盐食用的事件。欲测定某样品中NaNO2的含量,某同学设计如下实验:
①称取样品ag,加水溶解,配制成100mL溶液。
②取25.00mL溶液于锥形瓶中,用0.0200mol/LKMnO4标准溶液(酸性)进行滴定,滴定结束后消耗KMnO4溶液V mL。
(1)上述实验①所需玻璃仪器除烧杯、玻璃棒、胶头滴管之外还有____________。
(2)在进行滴定操作时,KMnO4溶液盛装在______(填“酸式”或“碱式”)滴定管中。当滴入最后一滴溶液,____________________________时达到滴定终点。
(3)滴定过程中发生反应的离子方程式是_________________;测得该样品中NaNO2的质量分数为___________。
(4)以下操作造成测定结果偏高的是__________。
A.滴定管未用KMnO4标准溶液润洗
B.锥形瓶未用待测液润洗
C.盛装标准溶液的滴定管,滴定前尖端有气泡,滴定后气泡消失
D.盛装标准溶液的滴定管,滴定前仰视凹液面最低处,滴定后俯视读数
E.若滴定过程中刚出现颜色变化就停止滴定
Ⅱ.(5)大量的碘富集在海藻中,用水浸取后浓缩。浓缩液中含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中![]() =____。(结果保留两位有效数字)(已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17)
=____。(结果保留两位有效数字)(已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17)
(6)已知25℃,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。若氨水的浓度为2.0 mol/L,溶液中的c(OH-)=________mol/L;将SO2通入该氨水中,当c(OH-)降至1.0×10-7mol/L时,溶液中的![]() =________。
=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下的密闭容器中:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH=-905.9 kJ/mol,下列叙述正确的是( )
4NO(g)+6H2O(g) ΔH=-905.9 kJ/mol,下列叙述正确的是( )
A. 4 mol NH3和5 mol O2反应,达到平衡时放出的热量为905.9 kJ
B. 平衡时5v正(O2)= 4v逆(NO)
C. 平衡后增大压强,混合气体的平均摩尔质量增大
D. 平衡后升高温度,混合气体中NO含量增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中,甲是电解饱和食盐水,乙是铜的电解精炼,丙是电镀,回答:

(1)b极上的电极反应式为__,甲电池的总反应化学方程式是__。
(2)在粗铜的电解过程中,图中c电极的材料是__(填“粗铜板”或“纯铜板”);在d电极上发生的电极反应为__;若粗铜中还含有Au、Ag、Fe等杂质,则沉积在电解槽底部(阳极泥)的杂质是__,电解一段时间后,电解液中的金属离子有__。
(3)如果要在铁制品上镀镍(二价金属,相对原子质量59),则f电极的材料是__(填“铁制品”或“镍块”,下同),e电极的材料是__。
(4)若e电极的质量变化118 g,则a电极上产生的气体在标准状况下的体积为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是一种常用的化工原料。
Ⅰ.以CO2与NH3为原料可以合成尿素[CO(NH2)2]。合成尿素的反应为2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g)。
CO(NH2)2(s)+H2O(g)。
(1)在不同温度及不同y值下合成尿素,达到平衡时,氨气转化率变化情况如图所示。该反应的ΔH_____0(填“>”、“<”或“=”,下同),若y表示压强,则y1_______y2 , 若y表示反应开始时的水碳比[n(NH3)/n(CO2)],则y1_______y2。

(2)t℃时,若向容积为2L的密闭容器中加入3molNH3和1molCO2,达到平衡时,容器内压强为开始时的0.75倍。若保持条件不变,再向该容器中加入0.5molCO2和1molH2O,NH3的转化率将__________(填“增大”、“减小”或“不变”)。
Ⅱ.CO2与H2反应可用于生产甲醇。
(3)已知氢气与甲醇的燃烧热分别为-285.8 kJ·mol-1、-726.5kJ·mol-1,则CO2与H2反应产生液态甲醇与液态水的热化学方程式为________________。
(4)下图是某甲醇燃料电池工作的示意图。质子交换膜(只有质子能够通过)左右两侧的溶液均为1L 2mol·L-1 H2SO4溶液。电极a上发生的电极反应式为________________________,当电池中有1mol e-发生转移时左右两侧溶液的质量之差为______g (假设反应物耗尽,忽略气体的溶解)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一种制取铜和其他产物的新工艺,原料的综合利用率较高。其主要流程如下:
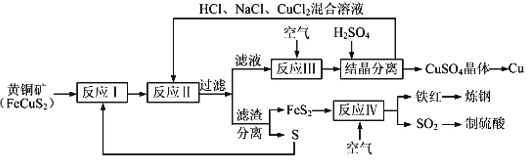
注:反应Ⅱ的离子方程式为Cu2++CuS+4Cl﹣=2[CuCl2]﹣+S
请回答下列问题:
(1)传统工艺制铜是将铜矿砂与空气在高温下煅烧,使这种方法的缺点是要消耗大量的热能以及____________________________(完成合理的一种即可)。
(2)为使反应Ⅰ中充分进行,工业可采取的措施是_________(完成合理的一种即可),反应Ⅰ的产物为(填化学式) ___________________。
(3)反应Ⅲ的离子方程式为______________________________________,一定温度下,在反应Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸铜晶体,其可能的原因是____________________________。
(4)工业上炼钢时,为了降低含碳量,可将铁红投入熔融的生铁(含碳量大于2%的铁碳合金)中,该过程中主要反应的化学方程式是___________________________________。
(5)某硫酸厂为测定反应Ⅳ所得气体中SO2的体积分数,取560mL(已折算成标准状况)气体样品与足量Fe2(SO4)3溶液完全反应后,用浓度为0.02000molL﹣1的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液50.00mL。
已知Cr2O72﹣+Fe2++H+→Cr3++Fe3++H2O(未配平)
①SO2通入Fe2(SO4)3溶液,发生反应的离子方程式为 ____________________________ 。
②反应Ⅳ所得气体中SO2的体积分数为_________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com