
【题目】在某温度时,将n mol/L的氨水滴入10 mL1.0 mol/L盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示,下列有关说法正确的是

A. a点KW=1.0×10-14
B. 水的电离程度:b﹥a﹥c﹥d
C. b点:c(NH4+)﹥c(Cl-)﹥c(H+)﹥c(OH-)
D. 25℃时NH4Cl水解平衡常数为(n-1)×10-7(用n表示)
【答案】D
【解析】
A.根据图象可知,a点时溶液温度小于25℃,则水的离子积小于1.0×10-14(mol/L)2;
B.b点时溶液温度最高,说明氨水与盐酸恰好反应,则b点溶质为氯化铵,NH4+水解促进了水的电离,则此时水的电离程度最大;由于d点溶液pH未知,则无法判断a、d两点水的电离程度大小;
C.该关系c(NH4+)>c(Cl-)>c(H+)>c(OH-)不满足电荷守恒;
D.25℃时溶液的pH=7,则c(H+)= c(OH-)=10-7mol/L,c(NH4+)=c(Cl-)=0.5mol/L,根据物料守恒可知:c(NH3H2O)=(0.5n-0.5)mol/L,然后结合铵根离子的水解平衡常数表达式计算。
A.水的离子积与温度有关,a点时溶液温度小于25℃,则水的离子积Kw<1.0×10-14mol2L-2,A错误;
B.b点溶液温度最高,说明此时两溶液恰好反应生成氯化铵,NH4+水解促进了水的电离,则a、d两点都抑制了水的电离,则b点水的电离程度最大;由于d点混合液的pH不知,则无法判断a、d两点水的电离程度大小,B错误;
C.b点时溶液的pH<7,则c(H+)>c(OH-),根据电荷守恒可知:c(Cl-)>c(NH4+),溶液中正确的离子浓度大小为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),C错误;
D.根据图象可知,25℃时溶液的pH=7,则:c(H+)=c(OH-)=10-7mol/L,c(Cl-)=c(NH4+)=0.5mol/L,根据物料守恒可知:c(NH3H2O)=(0.5n-0.5)mol/L,则25℃时NH4Cl水解常数为:K=![]() =(n-1)×10-7,D正确;
=(n-1)×10-7,D正确;
故合理选项是D。


科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示,若以A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度,则下列说法正确的是
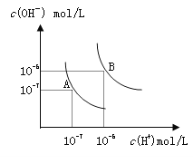
A. 纯水中25℃时的c(H+)比100℃时的c(H+)大
B. 100℃时某溶液中由水电离产生的c(H+)=1×10-11mol/L,则该溶液的pH可能是11或3
C. 将pH=9的Ba(OH)2溶液与pH=4的稀盐酸混合,并保持100℃的恒温,混合溶液的pH=7,则Ba(OH)2溶液和盐酸的体积比为10: 1
D. 25℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol/L,则溶液中c(Na+):c(OH-)为104:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的,如下图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化。则下列说法正确的是
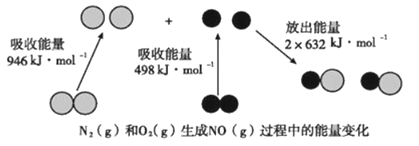
A. 通常情况下,NO比N2稳定
B. 通常情况下,N2(g)和O2(g)混合能直接生成NO
C. 1molN2(g)和1molO2(g)具有的总能量小于2mol NO(g)具有的总能量
D. 1molN2(g)和1molO2(g)反应放出的能量为180kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示:

(1)由图中所给数据进行分析,该反应的化学方程式为__________。
(2)若上述反应中X、Y、Z分别为H2、N2、NH3,某温度下,在容积恒定为2.0L的密闭容器中充入2.0mol N2和2.0mol H2,一段时间后反应达平衡状态,实验数据如表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3) | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
0~50s内的平均反应速率v(N2)=_________。
(3)已知:键能指在标准状况下,将1mol气态分子AB(g)解离为气态原子A(g),B(g)所需的能量,用符号E表示,单位为kJ/mol。![]() 的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1mol NH3过程中___(填“吸收”或“放出”)的能量为____,反应达到(2)中的平衡状态时,对应的能量变化的数值为____kJ。
的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1mol NH3过程中___(填“吸收”或“放出”)的能量为____,反应达到(2)中的平衡状态时,对应的能量变化的数值为____kJ。
(4)为加快反应速率,可以采取的措施是_______
a.降低温度
b.增大压强
c.恒容时充入He气
d.恒压时充入He气
e.及时分离NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能够表示燃烧热的是( )
A. 2H2(g)+O2(g)=2H2O(g);△H1
B. S(g)+O2(g)= SO2(g);△H2
C. C(s)+![]() O2(g)= CO(g);△H3
O2(g)= CO(g);△H3
D. H2(g)+Cl2(g) = 2HCl(g);△H4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
下列叙述不正确的是( )
A. 放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2
B. 放电时正极反应为:FeO42-+4H2O+3e-=Fe(OH)3+5OH-
C. 放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D. 放电时正极附近溶液的碱性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于各图的说法中正确的是
A.  ①中阳极处能产生使湿润淀粉-KI试纸变蓝的气体
①中阳极处能产生使湿润淀粉-KI试纸变蓝的气体
B. 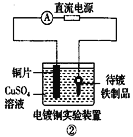 ②中待镀铁制品应与电源正极相连
②中待镀铁制品应与电源正极相连
C. 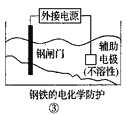 ③中钢闸门应与外接电源的负极相连,称为牺牲阳极的阴极保护法
③中钢闸门应与外接电源的负极相连,称为牺牲阳极的阴极保护法
D.  ④中离子交换膜可以避免生成的Cl2与NaOH溶液反应
④中离子交换膜可以避免生成的Cl2与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下的密闭容器中:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH=-905.9 kJ/mol,下列叙述正确的是( )
4NO(g)+6H2O(g) ΔH=-905.9 kJ/mol,下列叙述正确的是( )
A. 4 mol NH3和5 mol O2反应,达到平衡时放出的热量为905.9 kJ
B. 平衡时5v正(O2)= 4v逆(NO)
C. 平衡后增大压强,混合气体的平均摩尔质量增大
D. 平衡后升高温度,混合气体中NO含量增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),H=-akJmol-1,在5L密闭容器投入1molNH3和1mol的O2,2分钟后NO的物质的量增加了0.4mol,下列说法正确的是( )
4NO(g)+6H2O(g),H=-akJmol-1,在5L密闭容器投入1molNH3和1mol的O2,2分钟后NO的物质的量增加了0.4mol,下列说法正确的是( )
A.2分钟反应放出的热量值小于0.1akJ
B.用氧气表示0~2min的反应速率:v(O2)=0.05mol·L-1·min-1
C.2分钟内NH3的转化率是50%
D.2分钟末c(H2O)=0.6mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com