
| A. | 原子半径X>Y>Z | |
| B. | 电负性按X、Y、Z的顺序由弱到强 | |
| C. | 非金属性X>Y>Z | |
| D. | 气态氢化物的稳定性按X、Y、Z的顺序由弱到强 |
分析 同周期元素从左到右元素的非金属性逐渐增强,对应的最高价氧化物对应水化物的酸性逐渐增强,酸性相对强弱:H3ZO4<H2YO4<HXO4,可知非金属性X>Y>Z,原子序数X>Y>Z,再结合元素周期律解答.
解答 解:同周期元素从左到右元素的非金属性逐渐增强,对应的最高价氧化物对应水化物的酸性逐渐增强,酸性相对强弱:H3ZO4<H2YO4<HXO4,可知非金属性X>Y>Z,原子序数X>Y>Z.
A.同周期自左而右原子半径减小,故原子半径:X<Y<Z,故A错误;
B.同周期自左而右电负性增大,故电负性:X>Y>Z,故B错误;
C.最高价氧化物对应水化物的酸性是:H3ZO4<H2YO4<HXO4,则非金属性X>Y>Z,故C正确;
D.由于非金属性X>Y>Z,非金属性越强,氢化物越稳定,所以气态氢化物的稳定性:HX>H2Y>ZH3,故D错误,
故选C.
点评 本题考查元素周期律知识,题目难度不大,关键是对元素周期律理解,有利于基础知识的巩固.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2CO3的电离方程式H2CO3?2H++CO32- | |
| B. | HCO3-在水溶液中的电离方程式:HCO3-+H2O?H3O++CO32- | |
| C. | NaOH的电离方程式:NaOH?Na++OH- | |
| D. | CaCO3的电离方程式:CaCO3?Ca2++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
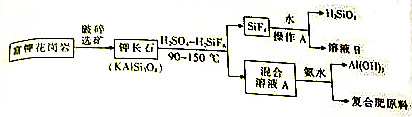
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与氧气反应的产物与反应条件无关 | |
| B. | 钠在反应中易失电子,表现出还原性 | |
| C. | 钠在氯气中燃烧产生红色火焰 | |
| D. | 钠只有在加热条件下才能与氯气发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:2 | B. | 1:3 | C. | 2:3 | D. | 1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
| A | 盐酸 | 漂白粉 | 硫酸 | 醋酸 | 干冰 |
| B | 氢氧化钡 | 蔗糖溶液 | 氯化银 | 溴水 | 二氧化硫 |
| C | 胆矾 | 石灰水 | 氧化铝 | 水 | 氯气 |
| D | 小苏打 | 氢氧化 铁胶体 | 胆矾 | 次氯酸 | 酒精 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
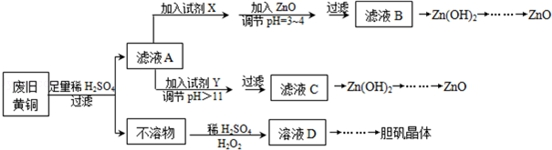
| Fe3+ | Fe2+ | Zn2+ | |
| 开始沉淀的pH | 1.1 | 5.8 | 5.9 |
| s沉淀完全的pH | 3.0 | 8.8 | 8.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把1mL饱和三氯化铁溶液逐滴加入到20 mL NaOH溶液中 | |
| B. | 把1mL饱和三氯化铁溶液逐滴加入到20mL冷水中,边加边振荡 | |
| C. | 把1mL饱和三氯化铁溶液一次性加入到20mL沸水中,并加热至红褐色 | |
| D. | 把1mL饱和三氯化铁溶液逐滴加入20mL到沸水中,边加边振荡 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com