
| 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
| A | 盐酸 | 漂白粉 | 硫酸 | 醋酸 | 干冰 |
| B | 氢氧化钡 | 蔗糖溶液 | 氯化银 | 溴水 | 二氧化硫 |
| C | 胆矾 | 石灰水 | 氧化铝 | 水 | 氯气 |
| D | 小苏打 | 氢氧化 铁胶体 | 胆矾 | 次氯酸 | 酒精 |
| A. | A | B. | B | C. | C | D. | D |
分析 纯净物是同种物质组成的物质,微观角度分析是一种分子构成;
混合物是不同物质组成的物质,微观角度分析是不同分子构成;
水溶液中或熔融状态下全部电离的电解质为强电解质,水溶液中部分电离的电解质为弱电解质;
水溶液中和熔融状态都不导电的化合物为非电解质.
解答 解:A.盐酸是氯化氢的水溶液属于混合物,漂白粉是氯化钙和次氯酸钙的混合物,硫酸水溶液中全部电离属于强电解质,醋酸水溶液中部分电离属于弱电解质,干冰是二氧化碳固体本身不能电离出离子属于非电解质,故A错误;
B.氢氧化钡是一种物质组成属于纯净物,蔗糖溶液是分散系属于混合物,氯化银熔融状态完全电离属于强电解质,溴水是混合物不是电解质,二氧化硅本身不能电离出离子属于非电解质,故B错误;
C.胆矾是硫酸铜晶体属于纯净物,石灰水是氢氧化钙的溶液属于混合物,氧化铝熔融状态完全电离属于强电解质,水是弱电解质,氯气是单质不是电解质、非电解质,故C错误;
D.小苏打是碳酸氢钠由一种物质组成属于纯净物,氢氧化铁胶体是分散质在分散剂中形成的混合物,胆矾是硫酸铜晶体溶于水全部电离属于强电解质,次氯酸是弱酸属于弱电解质,酒精水溶液中和熔融状态都不导电属于非电解质,故D正确;
故选D.
点评 本题考查了物质分类、物质组成、物质名称的分析判断,主要是概念实质的理解应用,熟练掌握化学基础是解题关键,题目较简单.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径X>Y>Z | |
| B. | 电负性按X、Y、Z的顺序由弱到强 | |
| C. | 非金属性X>Y>Z | |
| D. | 气态氢化物的稳定性按X、Y、Z的顺序由弱到强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由非极性键构成的非极性分子 | B. | 中心原子的杂化方式是sp2 | ||
| C. | 该分子的空间构型是平面三角形 | D. | 1mol该分子有2mol σ键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
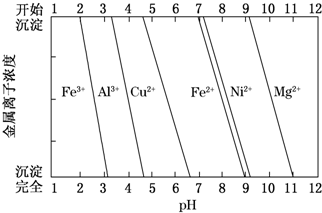
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
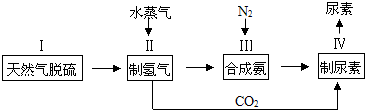
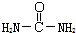 ,请写出尿素的同分异构体中含有离子键的化学式NH4OCN.
,请写出尿素的同分异构体中含有离子键的化学式NH4OCN.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 改变压强不可以改变反应速率 | |
| B. | 使用催化剂能同时增大正、逆反应的速率 | |
| C. | 增大压强能增大反应速率 | |
| D. | 升高温度能增大反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中含有1mol Na2SO4 | |
| B. | 500mL该Na2SO4溶液中SO42-的物质的量浓度为0.5 mol/L | |
| C. | 1L溶液中含有142gNa2SO4 | |
| D. | 1molNa2SO4溶于1LH2O配成溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com