
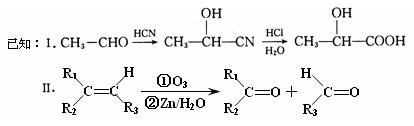
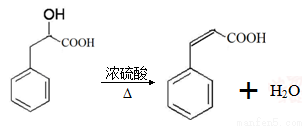
已知有机物A分子由C、H、O三种元素组成,其蒸汽密度是相同条件下氢气密度的60倍,0.1molA在足量的氧气中充分燃烧后生成0.8molCO和7.2gH2O,A可以发生银镜反应,其苯环上的一氯代物有3种。
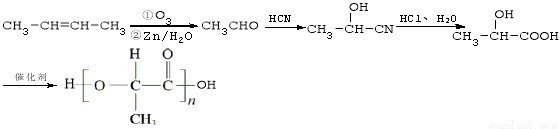
现有如下转化关系: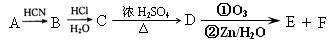 其中D能使溴的四氯化碳溶液褪色,F将继续氧化生成G,G的相对分子质量为90。
其中D能使溴的四氯化碳溶液褪色,F将继续氧化生成G,G的相对分子质量为90。
(1)A中含氧官能团的名称是 ,A的结构简式为 。
(2)C可能具有的化学性质有 (填序号)。
①能与H2发生加成反应
②能在碱性溶液中发生水解反应
③能与甲酸发生酯化反应
④能与Ag(NH3) 2OH溶液发生银镜反应
⑤能与NaOH溶液反应
A.①②③ B.①③⑤ C.①②③⑤ D.②③④⑤
(3) ① 写出C→D的化学反应方程式_______ ;反应类型为_____________________。
② 催化剂条件下,D生成高聚物的化学方程式 ;
③ G与足量NaHCO3溶液反应的化学方程式 。
(4)C的同分异构体有多种,其中符合下列要求的有机物有两种:
①属于酯类化合物 ②遇三氯化铁溶液显紫色
③与新制氢氧化铜悬浊液共热可生成红色沉淀 ④苯环上的一卤代物只有一种
写出其中一种有机物的结构简式 。
(5)聚乳酸(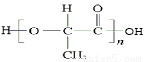 )可以生物降解,请写出以2-丁烯为原料制备聚乳酸的合成路线流程图(无机试剂任选)。
)可以生物降解,请写出以2-丁烯为原料制备聚乳酸的合成路线流程图(无机试剂任选)。
合成路线示例: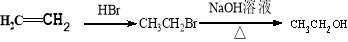
(1)醛基(2分), (2分) (2)B(2分)(3)消去反应(2分)
(2分) (2)B(2分)(3)消去反应(2分)
 ;
;
HOOC-COOH + 2NaHCO3→NaOOC-COONa + 2H2O + 2CO2↑(2分)
(4) (2分,每个一分)
(2分,每个一分)
(5) (3分)
(3分)
【解析】
试题分析:(1)机物A分子由C、H、O三种元素组成,其蒸汽密度是相同条件下氢气密度的60倍,则相对分子质量是60×2=120。0.1molA在足量的氧气中充分燃烧后生成0.8molCO和7.2gH2O,7.2g水的物质的量是0.4mol,所以A分子中碳氢原子数分别为8个和8个,则含有的氧原子数= =1,则A的分子式为C8H8O。A可以发生银镜反应,说明含有醛基,其苯环上的一氯代物有3种,说明苯环上有一个侧链,因此A的结构简式为
=1,则A的分子式为C8H8O。A可以发生银镜反应,说明含有醛基,其苯环上的一氯代物有3种,说明苯环上有一个侧链,因此A的结构简式为 ,含有的官能团是醛基。
,含有的官能团是醛基。
(2)根据已知信息I可知A与HCN发生醛基的加成反应生成B,则B的结构简式为 。B与氯化氢及水反应生成C,则根据信息可知C的结构简式为
。B与氯化氢及水反应生成C,则根据信息可知C的结构简式为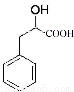 。①含有苯环能与H2发生加成反应正确;②含有羟基和羧基,不能在碱性溶液中发生水解反应,错误;③含有羟基能与甲酸发生酯化反应,正确;④没有醛基不能与Ag(NH3) 2OH溶液发生银镜反应,错误;⑤含有羧基能与NaOH溶液反应,正确,故答案选B。
。①含有苯环能与H2发生加成反应正确;②含有羟基和羧基,不能在碱性溶液中发生水解反应,错误;③含有羟基能与甲酸发生酯化反应,正确;④没有醛基不能与Ag(NH3) 2OH溶液发生银镜反应,错误;⑤含有羧基能与NaOH溶液反应,正确,故答案选B。
(3)①C分子中含有羟基,在浓硫酸的作用下反应生成D,D能使溴的四氯化碳溶液褪色,这说明该反应是羟基的消去反应,则D的结构简式为 ,反应的化学方程式为
,反应的化学方程式为 。
。
②D分子中含有碳碳双键发生加聚反应生成高分子化合物,其结构简式为 。
。
③D分子中含有碳碳双键,则根据已知信息②可知反应生成的E、F其结构简式为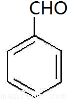 、OHC-COOH。由于F将继续氧化生成G,这说明醛基继续被氧化为羧基。根据G的相对分子质量为90可知,该化合物是乙二酸,结构简式为HOOC-COOH,所以E是
、OHC-COOH。由于F将继续氧化生成G,这说明醛基继续被氧化为羧基。根据G的相对分子质量为90可知,该化合物是乙二酸,结构简式为HOOC-COOH,所以E是 ,F是OHC-COOH。G与足量NaHCO3溶液反应的化学方程式为HOOC-COOH + 2NaHCO3→NaOOC-COONa + 2H2O + 2CO2↑。
,F是OHC-COOH。G与足量NaHCO3溶液反应的化学方程式为HOOC-COOH + 2NaHCO3→NaOOC-COONa + 2H2O + 2CO2↑。
(4)①属于酯类化合物,说明含有酯基;②遇三氯化铁溶液显紫色,说明含有酚羟基;③与新制氢氧化铜悬浊液共热可生成红色沉淀,说明还含有醛基,因此应该是甲酸形成的酯类;④苯环上的一卤代物只有一种,说明结构对称,所以符合条件的有机物结构简式为 。
。
(5)聚乳酸属于缩聚产物,其单体是乳酸,含有羟基与羧基,所以根据已知信息可知要引入羟基与羧基可以首先生成CH3CHOHCN。而要生成该化合物则需要乙醛与HCN发生加成反应,而乙醛的生成则可以利用2-丁烯的氧化反应即可,所以正确的合成路线为: 。
。
考点:考查有机物推断、官能团、有机反应类型、同分异构体判断、方程式的书写以及合成路线设计


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2013-2014学年广东省广州市番禺区高考统考(一)理综化学试卷(解析版) 题型:填空题
研究人员研制利用低品位软锰矿浆(主要成分是MnO2)吸收硫酸厂的尾气SO2,制备硫酸锰的生产流程如下:
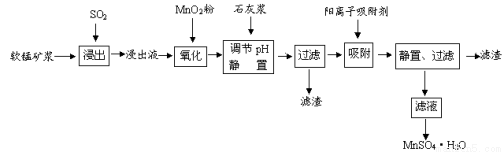
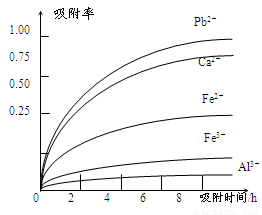
已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+等其他金属离子。PbO2的氧化性大于MnO2。PbSO4是一种微溶物质。有关金属离子的半径、形成氢氧化物沉淀时的pH见下表,阳离子吸附剂吸附金属离子的效果见下图。
离子 | 离子半径(pm) | 开始沉淀 时的pH | 完全沉淀 时的pH |
Fe2+ | 74 | 7.6 | 9.7 |
Fe3+ | 64 | 2.7 | 3.7 |
Al3+ | 50 | 3.8 | 4.7 |
Mn2+ | 80 | 8.3 | 9.8 |
Pb2+ | 121 | 8.0 | 8.8 |
Ca2+ | 99 | - | - |
请回答下列问题:
(1)写出浸出过程中生成Mn2+反应的化学方程式 。
(2)氧化过程中主要反应的离子方程式 。
(3)在氧化后的液体中加入石灰浆,用于调节pH值,此处调节pH值用到的仪器是 ,应调节pH的范围为 。
(4)阳离子吸附剂可用于除去杂质金属离子。请依据图、表信息回答,决定阳离子吸附剂吸附效果的因素有 、 等;吸附步骤除去的主要离子为: 。
(5)CaSO4是一种微溶物质,已知Ksp(CaSO4)=9.10×10—6。现将c mol·L—1CaCl2溶液与2.00×10—2 mol·L—1Na2SO4溶液等体积混合(忽略体积的变化),则生成沉淀时,c的最小值是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省枣庄市高三下学期第二次模拟考试理综化学试卷(解析版) 题型:选择题
下列离子方程式正确的是( )
A.Na2S2O3溶液中加入稀盐酸:2S2O32-+2H+=SO42-+3S↓+H2O
B.磁性氧化铁溶于稀硝酸:3Fe3O4+28H++NO3- 9Fe3++NO↑+14H2O
9Fe3++NO↑+14H2O
C.100ml0.1mol/L FeI2溶液与标况下0.224L Cl2: 2Fe2++ Cl2=2Fe3++2Cl-
D.向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH -=2 Al(OH)3↓+3BaSO4↓
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省德州市高三4月模拟考试(二模)理综化学试卷(解析版) 题型:填空题
V2O5是接触法制硫酸的重要催化剂,工业上生产V2O5的工艺流程如下:请回答下列问题:
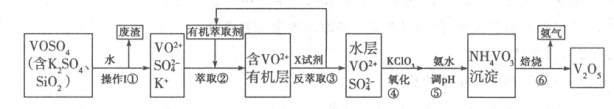
(1)步骤①所得废渣的成分是 (写化学式),它与NaOH溶液反应的离子反应方程式为 。
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n(水层)+2nHA(有机层) 2RAn(有机层)+nH2SO4(水层),
2RAn(有机层)+nH2SO4(水层),
①实验室中步骤②、③使用的主要仪器是 。
②中萃取时必须加入适量碱,其原因是 。
(3)步骤③中X试剂为 ,步骤④的目的是 ,步骤⑤的离子方程式为 。
(4)该工艺流程中,可以循环利用的物质有 和 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省德州市高三4月模拟考试(二模)理综化学试卷(解析版) 题型:选择题
下列说法中,正确的是
A.利用铁加入硫酸铜溶液中的反应可以比较Cu、Fe2+的还原性
B.足量的铜跟一定量的浓硝酸反应只产生一种气体
C.氮的固定只有在高温、高压、催化剂的条件下才能实现
D.以铁为阴极、铜片为阳极、硫酸铜为电镀液可以实现铁制品镀铜
查看答案和解析>>
科目:高中化学 来源:2013-2014学年天津市高三年级4月考理综化学试卷(解析版) 题型:选择题
X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如下转化关系(其它产物已略去): ,下列说法不正确的是
,下列说法不正确的是
A.若W是单质铁,则Z溶液可能是FeCl2溶液
B.若W是氢氧化钠,则X与Z可生成Y
C.若X是金属铝,则W可能是NaOH溶液
D.若X是甲醇,则X、的相对分子质量可能相差14
查看答案和解析>>
科目:高中化学 来源:2013-2014学年天津市七校高三4月联考理综化学试卷(解析版) 题型:选择题
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充放电池。下图为RFC工作原理示意图,有关说法正确的是:( )
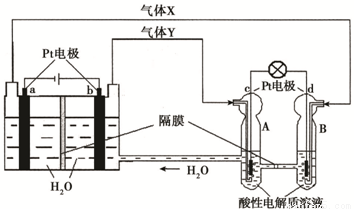
A.当有0.1 mol电子转移时,a极产生标准状况下1.12 L H2
B.左端装置中化学能转化为电能,右端装置中电能转化为化学能
C.c极上发生的电极反应是:O2 + 2H2O + 4e- = 4OH—
D.d极上进行还原反应,右端装置B中的H+可以通过隔膜进入A
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京市通州区高三年级模拟考试(一)理综化学试卷(解析版) 题型:实验题
节日期间因燃放鞭炮会引起空气中SO2含量增高,造成大气污染。某实验小组同学欲探究SO2的性质,并测定空气中SO2的含量。
(1)他们设计如下实验装置,请你参与探究,并回答问题:
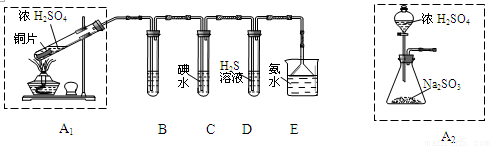
①装置A1中发生反应的化学方程式为 ;
②装置B用于检验SO2的漂白性,其中所盛试剂为 ,装置D用于检验SO2的 性质;
③装置C中反应的离子方程式为 ;
④为了实现绿色环保的目标,甲同学欲用装置A2代替装置A1,你认为装置A2的优点是(写二点) 、 ;
(2)他们拟用以下方法测定空气中SO2含量(假设空气中无其他还原性气体)。

①你认为哪个装置可行(填序号) ,使用你所选用的装置测定SO2含量时,还需要测定的物理量是 ;
②你认为哪个装置不可行(填序号) ,说明理由 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市闵行区高三二模化学试卷(解析版) 题型:选择题
已知在常温下测得浓度均为0.1mol/L的下列6种溶液的pH值:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
下列说法或表达中,正确的是
A.少量二氧化碳通入NaClO溶液中:2NaClO + CO2 + H2O Na2CO3 + 2HClO
Na2CO3 + 2HClO
B.过量的 HCN滴入碳酸钠溶液中 HCN + Na2CO3 NaCN+ NaHCO3
NaCN+ NaHCO3
C.结合质子能力由强到弱的顺序为:CO32—>CN—>HCO3—>CH3COO—
D.常温下电离常数:Ki2(H2CO3)>Ki(C6H5OH)>Ki(HCN)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com